항암치료 받는 악성 뇌종양 환자의 재발여부에 따른 지질프로필 비율의 비교
Comparison of Lipid Profile Ratios in Patients with High-grade Brain Cancers according to the Presence of Recurrence during Cancer-related Therapy
Article information
Abstract
Purpose: The purpose of this study was to identify the lipid profile ratios as factors affecting disease progress in patients with high-grade primary brain cancers undergoing concurrent chemoradiotherapy (CCRT) and adjuvant chemotherapy. Methods: The levels of lipid profile ratios were evaluated by looking at the total cholesterol (TC) to high-density lipoprotein (HDL)-cholesterol (TC/HDL-c), low-density lipoprotein (LDL)-cholesterol to HDL-cholesterol (LDL-c/HDL-c), and triglycerides to HDL-cholesterol (TG/HDL-c). This descriptive research was conducted 7 months after the initiation of CCRT and adjuvant chemotherapy. Results: A total of 36 patients with newly diagnosed primary malignant brain cancer were included in the study. The levels of lipid profile ratios such as TC/HDL-c, LDL-c/HDL-c, TG/HDL-c were significantly different between the patients with and without disease progress at 7 months after initiation of CCRT and adjuvant chemotherapy. Conclusion: The lipid profile ratios were indicators affecting disease prognosis with tumor-related factors at 7 months after initiation of CCRT and adjuvant chemotherapy. Therefore, lipid profile ratios indicating hyperlipidemia in patients with high-grade brain cancers should be carefully monitored during and after cancer-related therapy.
서 론
1. 연구의 필요성
우리나라에서는 매년 약 2,500-4,000명의 뇌종양 환자가 발생하며 인체에 발생하는 전체 종양 중에서 세번째로 많은 비율인 약 10%를 차지한다[1]. 원발성 뇌종양은 두개강내에 뇌조직을 구성하는 세포에서 발생한 것으로 다른 신체의 장기로 전이 되지 않는다. 그러나 원발성 뇌종양의 50% 이상이 WHO가 4단계로 분류한 악성도 III와 IV로 악성이며 정상 뇌조직과 경계가 불분명하고 주변 뇌 조직으로 암세포 전이가 빨라 질환의 위중도가 높다[2].
악성 뇌종양의 치료법은 진단 후 종양제거술로 최대한 종양을 제거하고 temozolomide의 경구용 항암화학요법과 방사선 치료를 시행하여 환자의 기대여명을 연장하거나 증상 또는 국소적 기능장애의 완화를 목적으로 한다[3]. 동시 항암화학방사선요법(concurrent chemoradiotherapy, CCRT)은 경구용 항암제와 방사선 요법을 동시에 시행하는 것으로 다른 치료법에 비해 기대여명을 높이는 것으로 알려져 있다. 악성 뇌종양 환자는 6주동안 방사선치료를 시행하면서(5일/주) 경구용 항암제 temozolomide 75 mg/m2를 매일 42-49일동안 복용하고 이후 항암제를 증량하여 6 cycle의 보조항암화학요법을 받게 된다[4]. CCRT 이후 환자의 평균 생존기간은 1.5-2년 미만으로 알려져 있으며 환자의 예후와 관련된 요인으로 수술 전 종양의 크기와 위치, 악성도, 종양적출정도, 다발성 여부, 신체적 기능상태가 제시되었다[5,6]. 수술 전 뇌종양의 크기가 5 cm 이상, 조직학적 분화도에 따른 악성도가 높고, 수술 후 잔여종양이 많을수록, 혈관이 많은 뇌조직으로 침투될수록, 뇌경막으로의 침범에 따른 다발성일 때, 진단 초기 환자의 신체적 기능상태가 낮을 때 환자의 예후는 좋지 않은 것으로 알려져 있다[7,8].
그러나 악성 뇌종양은 적극적인 치료법에도 불구하고 재발의 위험성이 높아[2] 종양과 관련된 요인 외에 예후에 영향을 미치는 다른 요인에 대해서도 살펴볼 필요가 있다. 활성산소(reactive oxygen species, ROS)는 세포내 필수적인 산화환원 신호전달물질로써 세포의 항상성 유지에 필수적이지만 인체의 항산화능력과 균형을 이루어야 한다[9]. 방사선과 항암화학요법에 쓰이는 많은 항암제가 인체의 항산화능력의 감소와 관련되며 상대적으로 높아진 체내의 활성산소는 DNA나 단백질, 지질 등 정상세포를 손상시키며 암세포의 증식에도 영향을 준다[10].
이러한 활성산소와 항산화능력의 불균형은 활성산소와 불포화지방산이 결합되어 유발되는 지질과산화(hyperlipidemia)로 나타난다[11]. 지질과산화를 나타내는 혈청 지질성분(lipid profile)은 총콜레스테롤(total cholesterol, TC), 저밀도 지단백 콜레스테롤(LDL-cholesterol, LDL-c), 고밀도지단백콜레스테롤(HDL-cholesterol, HDL-c), 중성지방(triglyceride, TG) 등이 있다. 이러한 각각의 지질 지표들은 체내에서 독립적으로 작용할 뿐만 아니라 대사작용을 통해 상호적으로 영향을 준다[9]. 이에 따라 TC/HDL-c, LDL-c/ HDL-c, TG/HDL-c와 같은 지질 지표의 비율은 개별지표보다 지질과산화를 나타내는 유의하게 나타내며 지방산 합성을 통해 증식하는 암 세포 대사과정에 영향을 줄 수 있는 위험지표로서 국외에서는 암환자의 재발과 관련된 예후인자로 제시된 바가 있다[12-15].
악성 뇌종양 환자의 예후와 관련된 국내연구는 종양과 관련된 요인에만 국한되어 있으며[5-8] 국외에서는 유방, 대장, 두경부, 전립선 등의 암환자에서 지질과산화 정도와 재발과 관련된 연구가 이뤄졌다[12,13,23,24]. 이에 항암치료기간 동안 암환자의 예후에 영향을 미치는 지질과산화를 악성 뇌종양 환자에서도 확인할 필요가 있으며 본 연구에서 악성 뇌종양 환자의 재발여부에 따른 지질프로필 비율의 관계를 확인하여 항암치료기간 동안 지질과산화 관리를 위한 기초자료를 제공하고자 한다.
2. 연구의 목적
본 연구는 항암치료를 받는 악성 뇌종양 환자의 재발여부에 따른 지질프로필 비율을 확인하고 이를 종양관련 요인과 비교하여 예후의 영향요인으로써 지질프로필 비율의 유용성을 규명하고자 함이다. 구체적인 목적은 다음과 같다.
악성 뇌종양 환자의 지질프로필 비율을 파악한다.
악성 뇌종양 환자의 재발 영향요인으로 종양관련요인과 지질프로필 비율을 파악한다.
악성 뇌종양 환자의 재발 영향요인으로 지질프로필 비율의 유용성을 검증한다.
연구 방법
1. 연구설계
본 연구는 악성 뇌종양 환자의 예후 영향요인으로 지질과산화를 확인하기 위해 대상자를 재발군과 비재발군으로 분류하여 지질프로필 비율을 비교한 서술적 조사연구이다.
2. 연구대상
대상자는 수도권에 위치한 일개 상급종합병원에서 악성 뇌종양으로 처음 진단 받고 입원 또는 외래치료를 진행한 36명의 대상자를 임의 표출하였다. 표본 수는 G-power 3.1.9 program을 이용하여 로지스틱 회귀분석을 시행하기 위해 선행연구[6,7,18]를 근거로 오즈비 3.5, 유의수준 .05, 검정력 .80로 산출한 결과, 필요한 최소 표본의 수는 34명이었으며 본 연구의 대상자 수는 36명으로 이를 충족하였다. 본 연구에서 대상자의 구체적인 선정기준과 제외기준은 다음과 같다.
1) 대상자 선정기준
만 19세 이상의 성인인 자
역형성 신경교종, 교모세포종으로 병리과 전문의에게 원발성 악성 뇌종양으로 진단받은 자
악성 뇌종양으로 종양제거술 후에 동시항암화학방사선요법과 보조항암화학요법을 지속할 수 있는 기능상태로 평가된 자(Karnofsky performance status ≥ 70점)
악성 뇌종양의 호전, 안정, 재발여부와 관련하여 신경외과 전문의의 의무기록을 통하여 그 내용을 확인할 수 있는 자
2) 대상자 제외기준
수술, 동시항암화학방사선요법과 보조항암화학요법 전에 우울, 불안, 수면 장애 등과 관련하여 정신과의 진료 또는 약물을 복용중인 자
대사증후군, 이상지질혈증으로 진료를 받은 과거력이 있거나 관련 약물을 복용중인 자
3. 연구도구
1) 일반적 및 질병관련 특징
대상자의 일반적 특성으로 성별, 연령, 배우자 유무, 교육수준, 직업유무를 조사하였으며 질병관련 특성으로 수술 전 종양의 크기와 위치, 악성도, 종양 적출 정도, 다발성 여부를 조사하였다. 질병관련 특성은 악성 뇌종양으로 처음 진단 받고 종양 제거술 또는 조직검사를 시행한 후 병리과 전문의에게 확인된 결과를 수집하였다.
2) 지질프로필 비율
본 연구에서 대상자의 지질프로필 비율은 TC/HDL-c, LDL-c/HDL-c, TG/HDL-c을 선정하였다. 지질프로필 검사는 최소 6시간 이상 금식을 한 대상자의 상완 정맥에서 채혈한 검체를 Toshiba 200FR (Toshiba Co., Tokyo, Japan)장비를 이용하여 enzymatic method로 시행하였다. 본 연구에서 지질과산화 정도를 나타내는 지질프로필 비율의 cut-off는 선행연구[16,17]를 근거로 TC/HDL-c ≥3.5, LDL-c/HDL-c≥2.5, TG/HDL-c≥3.0으로 정하였다. 지질프로필 비율은 동시항암화학방사선요법과 보조항암화학요법을 시작한 후 종료 시점인 7개월째에 시행한 결과를 이용하였다.
4. 자료수집방법 및 절차
본 연구의 자료수집은 2014년 1월부터 2016년 1월까지 진행하였다. 연구대상 병원의 연구윤리위원회의 심의 및 승인 후 시행하였으며(IRB No. B-1412/278), 연구대상병원의 의무기록을 통해 자료 수집하였다. 연구대상자는 악성 뇌종양 제거술과 동시항암화학방사선요법을 받고 보조항암화학요법을 시행하고 있는 대상자이다. 선행연구[18]에서 제시된 악성 뇌종양 환자의 추적 관찰시기이면서 재발평균기간인 7-10개월을 근거로 대상자의 동시항암화학방사선요법 시작 후의 7개월째 의무기록을 통해 뇌종양의 호전, 안정, 악화, 지질프로필 비율을 수집하였다. 의무기록에서 신경외과 전문의가 뇌종양의 호전 또는 안정으로 평가한 대상자는 비재발군으로 분류하였으며 악화로 확인된 대상자는 재발군으로 분류하였다.
5. 자료분석방법
본 연구에서 수집된 자료는 SPSS 23.0프로그램을 이용하여 분석하였다. 대상자의 일반적 특성 및 질병관련 특징을 기술통계로 분석하였다. 대상자를 재발군과 비재발군으로 분류하고 종양관련 요인과 지질프로필 비율의 비교를 Chi-square test와 Fisher’s exact test로 분석하였으며, 악성 뇌종양 재발에 따른 지질프로필 비율의 유용성을 검증하기 위해 종양관련 요인과 함께 로지스틱 회귀분석을 시행하였다.
연구 결과
1. 대상자의 일반적 및 질병관련 특징
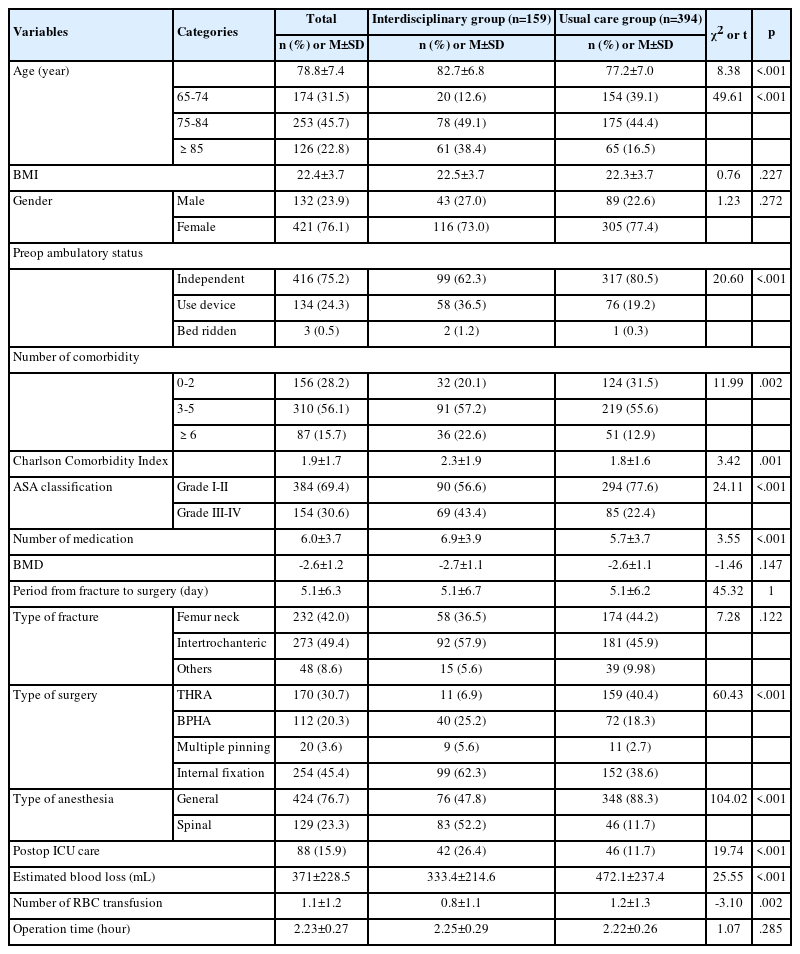
본 연구에 참여한 대상자는 총 36명으로 대상자의 일반적 및 질병관련 특징은 다음과 같다(Table 1). 연령은 청장년층인 40에서 64세가 20명(55.56%), 성별은 남성이 23명(63.89%), 배우자가 있는 기혼자가 25명(69.44%), 학력은 고졸이 11명(30.56%), 직업을 가진 취업자가 25명(69.44%)으로 가장 많은 비율을 나타냈다. 질병관련 특징으 로 다발성 악성 뇌종양이 22명(61.11%), 종양의 크기가 5 cm 이상이 19명(52.78%), 종양의 위치는 전두엽이 13명(36.12%), 악성도는 4단계가 19명(52.78%), 종양 적출방법은 전적출 대상자가 11명(30.56%)으로 가장 많은 비율을 보였다.
2. 재발군과 비재발군 대상자의 종양관련 및 지질프로필 비율의 비교
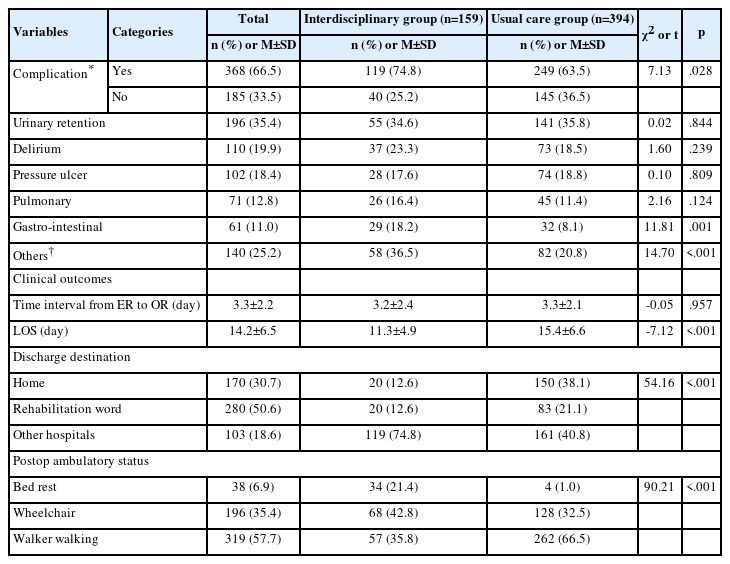
동시항암화학방사선요법과 보조항암화학요법을 종료한 7개월째에 대상자를 재발군과 비재발군으로 분류하여 종양관련요인과 지질프로필 비율을 비교한 결과는 다음과 같다(Table 2). 종양관련 요인인 종양의 다발성(χ2=6.374, p=.003), 크기(χ2=7.712, p=.017), 위치(χ2=2.759, p=.031), 종양 적출방법(χ2=11.245, p=.011)이 모두 두 군에서 유의한 차이를 보였으며, 지질프로필 비율인 TC/HDL-c (χ2=2.431, p=.039), LDL-c/HDL-c (χ2=1.375, p=.040), TG/HDL-c (χ2=1.892, p= .028)도 모두 두 군에서 유의한 차이를 나타냈다.
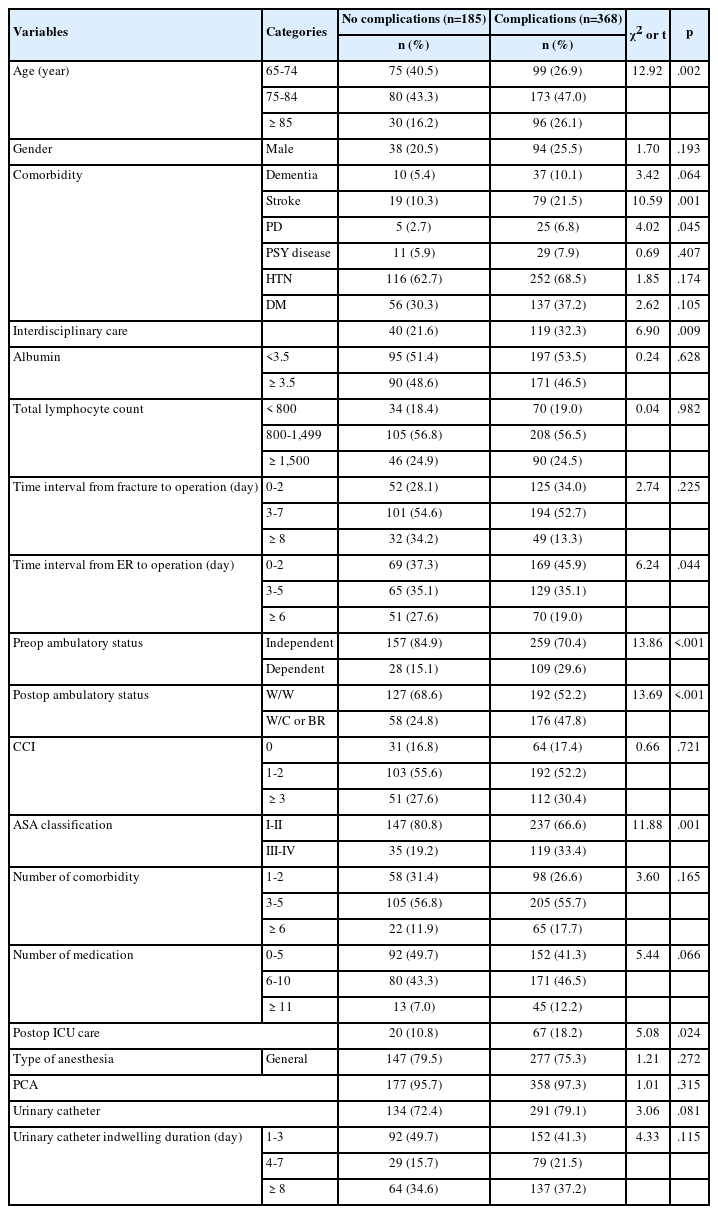
3. 대상자의 예후에 영향을 미치는 요인
뇌종양 대상자의 예후에 영향을 미치는 요인을 분석하기 위해 질병 재발을 종속변수로 하고 뇌종양 환자의 재발 위험요인으로 알려진 종양관련 요인의 종양의 다발성 여부, 종양크기, 위치, 정양적출 방법을 통계적으로 보정하고 지질프로필 비율인 TC/HDL-c, LDL-c/HDL-c, TG/HDL-c의 영향력을 로지스틱 회귀분석으로 분석한 결과는 다음과 같다(Table 3). 악성 뇌종양 재발의 영향요인으로 지질프로필 비율 TC/HDL-c (위험도 2.08, 신뢰구간 1.45-43.76, p=.027), LDL-c/HDL-c (위험도 1.76, 신뢰구간 1.56-37.62, p=.043), TG/HDL-c (위험도 2.23, 신뢰구간 1.89-45.54, p=.031)이 모두 통계적으로 유의하였다. TC/HDL-c가 ‘≥ 3.5’인 사람은 ‘<3.5’비해 재발 위험이 2.08배 높은 것으로 나타났으며, LDL-c/HDL-c가 ‘≥ 2.5’인 사람은 ‘<2.5’비해 재발 위험이 1.76배 높은 것으로 나타났다. TG/HDL-c이 ‘≥ 3.0’인 사람은 ‘<3.0’비해 재발 위험이 2.23배 높은 것으로 나타났다.
논 의
본 연구는 악성 뇌종양 환자의 예후에 영향을 주는 요인으로 지질과산화를 확인하기 위해 대상자를 재발군과 비재발군으로 분류하여 동시항암화학방사선요법과 보조항암화학요법의 종료시점인 7개월째에 지질프로필 비율을 비교한 서술적 조사연구이다.
체내에서 지단백의 형태로 존재하는 콜레스테롤은 암세포를 포함한 모든 세포막과 신경조직의 성분으로 체내의 에너지원 및 신호전달매개의 역할을 한다[14]. 지질과산화(hyperlipidemia)는 지단백 대사의 이상으로 혈장 내의 총 콜레스테롤(TC), 저밀도지질단백 콜레스테롤(LDL-c), 중성지방(TG)이 상승하거나 고밀도지질단백 콜레스테롤(HDL-c)의 감소와 관련된다[13]. 또한 각각의 지단백 지표들의 대사가 독립적으로 나타날 뿐만 아니라 상호복합적인 형태로 나타나는 것이 밝혀지면서 관상동맥 질환자와 대사증후군 환자의 위험지표로써 지질프로필 비율은 개별 지표들의 비교보다 더 유의하게 이용되고 있다[11,12,17]. 본 연구에서 악성 뇌종양 재발군은 TG/HDL-c, LDL-c/HDL-c, TC/HDL-c비율에서 지질과산화 위험수준의 대상자수가 비재발군보다 유의하게 많은 것으로 나타났으며, 재발군과 비재발군에서 종양관련요인과 함께 분석한 결과 TG/HDL-c, LDL-c/HDL-c, TC/HDL-c가 모두 유의한 영향요인으로 나타났다. 이는 다른 장기의 암환자이지만 예후 영향요인으로 지질과산화를 제시한 선행연구[18,19,22]들과 유사한 결과이다. 증식속도가 빠른 암세포의 대사에는 정상세포보다 더 많은 지단백이 필요하므로 활성산소와 불포화지방산의 결합으로 유발된 지질과산화는 항암치료과정에서 조절되어야 하는 위험요인이다[22]. 항암치료기간 동안 암환자의 지질과산화는 체내의 항산화능력을 감소시키는 항암제나 방사선 치료과정에서 유발되며 유방암, 대장암, 간암, 전립선암 환자에서 위험요인으로 연구된 바가 있다[21-24]. 본 연구의 결과를 통해 악성 뇌종양 환자에서도 지질지표 비율을 예후관련 위험요인으로 고려해볼 필요가 있을 것으로 생각되며 암세포의 대사 및 전이와 관련되어 항암치료기간에 변화될 수 있는 생체지표에 대한 연구가 확대되어야 할 것이다.
본 연구에서 종양관련요인과 지질프로필 비율을 악성 뇌종양 재발군과 비재발군에서 분석한 결과 뇌종양의 크기와 위치, 다발성 여부, 종양 적출방법이 재발군와 비재발군에서 유의한 차이를 보였고 이는 예후에 영향을 주는 요인으로 종양관련요인을 제시한 선행연구[7,8]와 유사한 결과이다. 또한 TG/HDL-c과 TC/HDL-c 비율이 LDL-c/HDL-c보다 질환 위험예측도가 높았으며 이는 유방암, 전립선 암환자의 선행연구[23,24]에서 TG/HDL-c, TC/HDL-c 비율이 질환의 위험 예측도가 높았던 것과 유사하다. TG/HDL-c, TC/HDL-c 비율은 인슐린 저항성과 매우 밀접하게 관련되는데 이는 중성지방인 TG의 증가가 인슐린 저항성을 악화시키고 HDL-c 감소에 영향을 주어 지질대사를 더 유의하게 나타내기 때문이다[21]. 세포독성 항암제는 지질대사 이상을 유발하여 체내에 중성지방을 증가시키므로[11] 본 연구결과를 통해 항암치료기간 동안 세포독성 항암제인 temozolomide를 복용하는 악성 뇌종양 환자의 중성지방 수치변화의 관찰연구와 이를 중재하기 위한 임상연구가 시도되어야 할 것으로 사료된다.
동시항암화학방사선치료와 보조항암화학요법은 방사선으로 종양의 원발 병소를 치료하고 항암화학요법으로 전신의 미세 전이를 치료하는 것으로 암치료의 단독요법보다 종양제거율과 환자의 기대여명을 높이는 것으로 알려져 있다. 그러나 항암화학치료와 동시에 방사선 치료를 시행하므로 항암치료와 관련된 비의도적 부작용이 유발될 수 있고 이는 두경부암, 식도암, 유방암 환자의 선행연구에서도 확인되었다[17-20]. 본 연구는 동시항암화학방사선요법과 보조항암화학요법을 받는 악성 뇌종양 환자를 대상으로 지질과산화를 확인하였으며 이는 항암화학치료 또는 방사선 치료의 단일 치료를 받는 암환자를 대상으로 한 선행연구[17-20]와 차별성이 있다. 악성 뇌종양은 기대여명이 짧고 질병의 위중도가 높아 대부분의 선행연구가 종양과 관련된 요인에 국한되어 있다. 이에 본 연구에서 항암치료를 받는 악성 뇌종양 환자의 재발군과 비재발군에서 지질과산화를 영향요인으로 비교 및 검토한 것에 의의가 있으며 항암치료기간 동안 지질과산화와 관련된 지질프로필 비율을 주의 깊게 관찰하고 예후의 영향요인으로 검토되어야 할 것이다.
결 론
본 연구는 악성 뇌종양 환자의 재발여부에 따라 기존에 알려진 종양관련요인들과 함께 지질프로필 비율을 예후영향요인으로 비교분석한 연구이다. 연구결과 악성 뇌종양 재발군은 지질과산화 상태의 대상자수가 유의하게 많은 것으로 나타났으며 악성 뇌종양 재발의 위험요인으로 TC/HDL-c, LDL-c/HDL-c, TG/HDL-c 비율이 유의하게 영향을 미치는 것으로 나타났다.
본 연구는 항암치료기간 동안 악성 뇌종양 환자의 재발여부에 따라 종양관련요인과 지질프로필 비율을 함께 고려한 연구로써 의의가 있다. 본 연구의 제한점으로 첫째, 수도권에 소재한 일개의 상급종합병원에 내원한 악성 뇌종양 환자를 편의모집 하였으므로 연구결과의 일반화에 신중을 기하여야 한다. 둘째, 항암치료기간의 7개월째 단일시점에서 재발여부에 따른 지질프로필 비율을 조사하였으므로 추후 여러 시점에서 지질프로필 비율을 측정하여 종양관 련요인들과 비교하는 전향적 다기관 연구를 제언한다.