의사결정나무 분석을 이용한 이상지질혈증 유병자의 지질관리 취약군 예측: 2019-2021년도 국민건강영양조사 자료
Identification of subgroups with poor lipid control among patients with dyslipidemia using decision tree analysis: the Korean National Health and Nutrition Examination Survey from 2019 to 2021
Article information
Trans Abstract
Purpose
The aim of this study was to assess lipid levels and to identify groups with poor lipid control group among patients with dyslipidemia.
Methods
Data from 1,399 Korean patients with dyslipidemia older than 20 years were extracted from the Korea National Health and Nutrition Examination Survey. Complex sample analysis and decision-tree analysis were conducted with using SPSS for Windows version 27.0.
Results
The mean levels of total cholesterol (TC), triglyceride (TG), low density lipoprotein-cholesterol (LDL-C), and high density lipoprotein cholesterol were 211.38±1.15 mg/dL, 306.61±1.15 mg/dL, 118.48±1.08 mg/dL, and 42.39±1.15 mg/dL, respectively. About 61% of participants showed abnormal lipid control. Poor glycemic control groups (TC ≥ 200 mg/dL or TG ≥ 150 mg/dL or LDL-C ≥ 130 mg/dL) were identified through seven different pathways via decision-tree analysis. Poor lipid control groups were categorized based on patients’ characteristics such as gender, age, education, dyslipidemia medication adherence, perception of dyslipidemia, diagnosis of myocardial infarction or angina, diabetes mellitus, perceived health status, relative hand grip strength, hemoglobin A1c, aerobic exercise per week, and walking days per week. Dyslipidemia medication adherence was the most significant predictor of poor lipid control.
Conclusion
The findings demonstrated characteristics that are predictive of poor lipid control and can be used to detect poor lipid control in patients with dyslipidemia.
서 론
1. 연구의 필요성
이상지질혈증은 고혈압, 당뇨병, 흡연과 더불어 국내 사망원인 2위인 심뇌혈관계 질환의 주요한 위험인자 중 하나로서[1], 국내 뿐만이 아니라 전 세계적으로도 점차 건강부담이 커지고 있는 질환이다[1]. 한국지질·동맥경화학회의 진단기준[2]에 따르면 이상지질혈증은 총콜레스테롤(total cholesterol, TC), 중성지방(triglyceride, TG), 저밀도지단백 콜레스테롤(low density lipoprotein-cholesterol, LDL-C)이 비정상적으로 증가하거나 고밀도지단백 콜레스테롤(high density lipoprotein-cholesterol, HDL-C)이 비정상적으로 감소하는 특징이 있는 지질과 지단백 이상으로 정의된다[2]. 2020년 국내 만성질환 관련 통계자료[1]에 의하면 우리나라 성인의 경우 20세 이상의 성인 약 40%가 이상지질혈증을 가지고 있을 정도로 유병율이 높은데 구체적으로 고콜레스테롤혈증 유병율은 2005년 8.0%에서 2020년 23.9%까지 증가하였고, 고LDL-콜레스테롤혈증 또한 2007년 8.75%에서 2020년 19.1%로 급속하게 증가한 양상을 보이고 있다. 이러한 이상지질혈증은 비만, 흡연, 음주, 운동부족 등의 생활습관으로 발생할 위험이 높고[1,3], 당뇨병, 고혈압, 관상동맥 질환, 대사증후군, 죽상경화증 발병과도 밀접하게 관련이 있는 것으로 알려져 있다[1,3,4].
이상지질혈증의 경우 치료대상자 판정을 위한 선별지질 검사가 필요하지만[2], 지방과 지단백 이상이 있다할지라도 환자 스스로 질병을 인지할 수 있는 뚜렷한 증상이 없기 때문에 적절한 치료시기를 놓칠 수 있고, 발병 후에는 만성질환으로서 일생 동안 건강한 생활습관 유지와 지속적인 약물복용이 요구된다[2,5]. 국내 성인 대상의 지질관리 양상을 살펴보면, 고콜레스테롤혈증 인지율은 64.6%, 치료율은 56.7%, 유병자 중 조절률은 49.0%에 불과하였고 지질강하제 약물 또한 고콜레스테롤 혈증 유병자 중 약 50%에서만 복용하고 있는 것으로 분석되어 심혈관계 질환 등의 합병증 감소를 위해 이상지질혈증 유병자의 지질관리가 중요한 이슈로 대두되고 있다[6].
이상지질혈증의 지질관리에는 신체활동 증진, 금연, 절주 등의 생활습관 유지, 심혈관 질환 위험도 모니터링, 지질강하 약물복용 이행, 고혈압, 당뇨병 등의 만성질환 관리 등이 포함된다[7]. 선행연구에 의하면 이상지질혈증은 성별[3,8], 연령[9], 비만[3,9], 고혈압, 당뇨 등의 만성질환[10,11], 흡연[12], 신체활동[12], 악력[13,14], 인슐린 저항성[15] 등과 연관이 있는 것으로 분석되었으나 선행연구들은 각각의 위험요인별로 이상지질혈증 간의 관계성만을 파악한 연구가 대부분이었고[3,9,10,13-15], 이상지질혈증 유병자 각각의 특성들이 서로 연관성을 가지고 이상지질혈증의 지질관리 취약군을 형성하는지에 대한 분석은 없는 실정이다. 기존 연구들 중에서 노모그램을 이용하여 이상지질혈증 위험군을 분석한 연구는 있었으나[9], 관련 위험요인으로 투입된 변수들이 주로 대상자의 일반적인 특성에 한정이 되어 있으며, 지질 관련 생리적 지표 등을 포함하지 않았을뿐더러 이상지질혈증 예측발생에 주로 초점이 맞추어져 있어 포괄적인 지질관리 취약군을 설명하는데에는 한계가 있다. 따라서, 무엇보다 기존의 선행연구 결과에서 나타난 제한점을 보완하여 이상지질혈증 지질관리에 미치는 영향요인들을 정교하고 체계적으로 분석하는 연구가 이루어질 필요가 있다. 이에, 대표성이 높고 여러 만성질환 관련하여 다양한 변수가 포함된 국민건강영양조사 자료를 분석하여 이상지질혈증의 지질관리 취약군을 분류하는 연구는 의미가 있다.
그러므로 대표성이 있는 국민건강영양조사 자료를 이용하여 성인을 대상으로 이상지질혈증 유병율, 인지율, 치료율을 파악하여 현 이상지질혈증의 유병자 현황을 분석하고, 이상지질혈증 지질관리 취약군을 예측하는 모형을 분석한 연구는 필요하다 하겠다. 이에 따라 본 연구의 목적은 이상지질혈증 유병자를 대상으로 지질관리 취약군을 예측할 수 있는 모형을 확립하는 것이다.
2. 연구 목적
본 연구 목적은 제 8기(2019-2021년)의 총 3개년도 국민건강영양조사 원시자료를 이용하여 만 19세 이상의 성인 이상지질혈증 유병자의 인구사회학적 및 질병관련 특성, 생리적 지표와 건강행태를 파악하고, 지질관리 취약군을 규명하기 위함이다.
연구 방법
1. 연구 설계
본 연구는 이차자료 분석연구로서, 국내 만 19세 이상의 성인 이상지질혈증 유병자의 지질혈증 관련 특성을 파악하고, 지질관리 취약군을 예측하기 위한 서술적 조사연구이다.
2. 연구 대상
본 연구대상자는 우리나라 제8기(2019년-2021년) 국민건강영양조사에 참여한 만 19세 이상의 성인 이상지질혈증 유병자이다. 국민건강영양조사에서는 대상자를 다단계 층화집락 표본 추출법에 의해 표집하며, 제8기 조사에 참여한 대상자 총 22,559명 중에 만 19세 이상 성인 대상자는 18,691명이었다. 본 연구에서는 대한지질·동맥경화학회와 선행연구들[1,5,6]의 선정기준을 참고하여 다음의 6가지 기준 중 하나라도 만족하는 경우 이상지질혈증 유병자로 정의하였다. 1) 의사로부터 이상지질혈증으로 진단받았다고 자가보고한 경우, 2) 조사 당시 이상지질혈증 치료제를 복용하고 있는 경우, 3) 고콜레스테롤혈증(TC ≥ 240 mg/dL)인 경우, 4) 고중성지방혈증(TG ≥ 200 mg/dL)인 경우, 5) 고LDL-콜레스테롤혈증(LDL-C ≥ 160 mg/dL)인 경우, 6) 저HDL-콜레스테롤혈증(HDL-C < 40 mg/dL)인 경우였다. 만 19세 이상이면서 위의 선정기준에 적합한 대상자는 7,814명이었고, 이들 중에서 이상지질혈증 진단 여부, 이상지질혈증 약물복용 여부 및 이상지질혈증 기준 지표값(콜레스테롤, TG, LDL, HDL) 결과가 없는 자를 제외한 대상자는 2,355명었다. 이들 대상자 중 만성질환(고혈압, 당뇨병, 심장질환, 또는 뇌졸중) 중 한 항목이라도 응답하지 않는 자 286명, 건강행태(흡연, 음주, 유산소운동, 근력운동, 걷기) 중 한 항목이라도 응답하지 않는 자 402명, 생리적 지표(혈압, 체질량지수, 허리둘레, 공복혈당, 당화혈색소[HemogobinA1c, HbA1c], 체질량지수) 중 한 항목이라도 응답하지 않는 자 268명을 제외한 총 1,399명을 최종 연구대상자로 선정하였다.
3. 연구 도구
본 연구에서는 선행연구[2,5-8]를 참조하여 이상지질혈증 지질관리 관련 요인들로 보고된 항목들을 연구변수로 선정하였고, 인구사회학적 및 질병관련 특성, 생리적 지표, 건강행태 특성으로 구분하였다.
1) 인구사회학적 및 질병관련 특성
인구사회학적 특성은 연령, 성별, 교육수준, 소득수준, 직업 여부 5개 항목을, 질병관련 특성은 이상지질혈증 인지 여부, 이상지질혈증 약물복용 여부, 혈중 지질관리 여부, 만성질환(고혈압, 당뇨병, 뇌졸중, 심근경색증 혹은 협심증) 진단 여부, 주관적 건강상태, 지각된 스트레스 9개 항목을 조사하였다. 구체적으로 교육수준은 ‘고등학교 졸업 이하’와 ‘대학교 졸업 이상’으로, 소득수준은 월평균 개인소득 ‘상’, ‘중’, ‘하’로 구분하였으며, 직업은 ‘유’와 ‘무’로 재분류하였다.
질병관련 특성 중 이상지질혈증 인지 여부는 본 연구에서 이상지질혈증 유병자 중 의사로부터 이상지질혈증으로 진단받은 경우를 ‘질병 인지군’으로, 이상지질혈증 유병자 대상 기준에 포함되지만 의사로부터 이상지질혈증 진단을 받지 않은 경우 ‘질병 미인지군’으로 분류하였다[1]. 이상지질혈증 약물복용 여부는 ‘혈중 콜레스테롤을 낮추기 위해 현재 약물복용하고 있습니까’ 질문에 매일 복용 혹은 한달에 20일 이상 복용한 경우를 ‘약물복용 이행군’으로, 한달에 15일 이상, 한달에 15일 미만, 복용하지 않는 경우를 ‘약물복용 미이행군’으로 구분하였다[1]. 이상지질혈증 조절 여부는 전체 이상지질혈증 유병자 중에서 지질혈증이 정상 범위에 있는 경우를 의미하며[1], 혈중 지질관리는 대한지질·동맥경화학회에서 제시한 한국인의 이상지질혈증 분류 및 진단기준[2]과 선행연구[16]을 참고하여 혈중 콜레스테롤, TG, LDL-C 중 모든 혈중 지표가 정상 범위에 속했을 때 즉, TC 200 mg/dL 미만이고 LDL-C 130 mg/dL 미만이면서 TG 150 mg/dL 미만을 모두 만족한 경우 ‘이상지질혈증 조절군’으로 분류하였고, 혈청 지질 3가지 중 한 개의 지표라도 비정상 범위에 속했을 때 즉, TC 200 mg/dL 이상, LDL-C 130 mg/dL 이상, TG 150 mg/dL 이상에서 한 개라도 해당되는 경우 ‘이상지질혈증 미조절군’으로 구분하였다. 만성질환 진단 여부는 고혈압, 당뇨병, 뇌졸중, 심근경색증 혹은 협심증을 의사로부터 진단받은 경우로 구분하였다. 주관적 건강상태는 매우 좋음과 좋음을 ‘좋음’으로, ‘보통’, 나쁨과 매우 나쁨을 ‘나쁨’으로 재분류하였고, 지각된 스트레스의 경우 평소 일상생활 중에 스트레스를 ‘대단히 많이’ 혹은 ‘많이’ 느끼는 경우’를 ‘스트레스 지각이 높은 군’으로, ‘조금 느끼는 경우’ 혹은 ‘거의 느끼지 않는 경우’를 ‘스트레스 지각이 낮은 군’으로 재분류하였다.
2) 생리적 지표
생리적 지표는 체질량지수, 허리둘레, 수축기혈압, 이완기혈압, 악력 5개 항목과, TC, TG, LDL-C, HDL-C, 공복혈당, HbA1c 자료 6개 항목을 이용하였다. 체질량지수는 저체중(< 18.5 kg/m2), 정상(18.5 kg/m2-< 25 kg/m2), 비만(≥ 25 kg/m2)으로 분류하였다. 복부비만은 허리둘레를 이용하여 남자 90 cm 이상, 여자 80 cm 이상인 경우 복부비만군으로 재분류하였다. 수축기혈압과 이완기혈압은 2, 3차 수축기혈압과 이완기혈압 평균값을 이용하였으며, 대한고혈압학회에서 제시한 고혈압 진단기준을 참고하여[17] 수축기 혈압은 140 mmHg 미만과 140 mmHg 이상으로, 이완기 혈압이 90 mmHg 미만과 90 mmHg 이상으로 재분류하였다. 악력은 오른손, 왼손 각각 3회씩 측정한 6개의 값 중에서 최대값을 절대악력값으로 구한 후, 체중이 악력에 영향을 주기 때문에 절대악력값을 체중으로 나눈 상대악력값을 이용하였다. 그 후 군집분석(k-means analysis)을 통해 나타난 평균 상대악력값보다 낮은 그룹인 ‘악력이 낮은 군’과 평균 상대악력값보다 높은 그룹이 ‘악력이 높은 군’ 으로 재분류하였다.
혈액검사 수치들은 정상범위 수치를 이용하여 구분하였으며, 혈청지질검사는 8시간 금식 후 혈액을 채취하여, 냉동 후 24시간 이내 분석되었고 TC, TG, LDL-C, HDL-C 농도는 효소성 방법으로 분석기(Hitachi Automatic Analyzer 7600, Hitachi, Tokyo, Japan)를 이용하여 측정되었다. 본 연구에서는 대한지질·동맥경화학에서 제시한 이상지질혈증 분류기준을 기반으로 TC 200 mg/dL 이상인 경우, TG 150 mg/dL 이상인 경우, LDL-C 130 mg/dL 이상인 경우, HDL-C 40 mg/dL 미만인 경우 비정상군으로 구분하였다[2]. 혈당검사는 8시간 금식 후 측정하였으며, 대한당뇨병학회가 제시한 당뇨병 진단기준을 참고하여[18] 공복혈당은 126mg/dL 이상인 경우, HbA1c는 6.5% 이상인 경우 비정상군으로 구분하였다. 인슐린 저항성은 정상적인 인슐린 작용에 대해 세포가 반응하지 않는 상태로서, 본 연구에서 인슐린 저항성 평가는 가장 흔히 사용되는 혈중 인슐린 농도와 공복혈당을 이용한 인슐린 저항성 지수(Homeostatic Model Assessment for Insuline, HOMA-IR)을 활용하여 계산값(HOMA-IR = [fasting plasma glucose (mg/dL) × fasting insulin (uIU/mL)]/405)을 산출하였고[19], 한국인 비당뇨 성인을 대상으로 대사증후군과 관련된 인슐린 저항성 지표값을 제시한 선행연구[20] 결과에 근거하여 HOMA-IR값이 2.34 이상인 경우 인슐린 저항성이 있는 것으로 구분하였다.
3) 건강행태
건강행태는 흡연, 음주, 신체활동(유산소운동, 걷기, 근력운동)으로 5개 항목을 조사하였다. 흡연은 ‘비흡연자 및 과거흡연자’와 ‘현재 흡연자’로 구분하였고, 음주는 월간 음주율로 ‘평생 비음주 혹은 최근 1년간 월1잔 미만’과 ‘최근 1년간 월1잔 이상 음주’로 구분하였다. 신체활동 유형은 국제신체활동 설문지(Global Physical Activity Questionnaire, GPAQ)를 이용하여 조사한 항목 중, 유산소운동, 근력운동 및 걷기운동으로 구분하여 조사하였다. GPAQ 설문항목은 각 영역별로 일주일 동안 시행한 신체활동의 빈도와 시간을 응답하도록 구성되어 있다. 유산소 운동은 일, 장소이동, 여가활동 영역에서 ‘일주일에 중강도 신체활동(숨이 약간 차거나 심장이 약간 빠르게 뛰는 활동)을 2시간 30분 이상 또는 고강도 신체활동(숨이 많이 차거나 심장이 매우 빠르게 뛰는 활동)을 1시간 15분 이상 또는 중강도와 고강도 신체활동을 혼합하여(고강도 1분=중강도 2분으로 계산) 각 활동에 상당하는 시간을 실천하는 경우’를 유산소운동 실천자로 구분하였다. 근력운동은 ‘최근 1주일 동안 팔굽혀 펴기, 윗몸 일으키기, 아령, 역기, 철봉 등의 근력운동을 한 날은 며칠입니까’ 항목에 주 2일, 3일, 4일, 5일 이상’으로 응답한 경우를 근력운동 실천자로 구분하였다. 걷기운동은 ‘최근 1주일 동안 한번에 적어도 10분 이상 걸은 날은 며칠입니까’ 항목과 ‘이러한 날 중 하루 동안 걷는 시간은 보통 얼마나 됩니까’ 항목에 ‘주 5일 이상이면서 1일 30분 이상’으로 응답한 경우를 걷기운동 실천자로 구분하였다.
4. 자료 수집
본 연구는 제8기(2019-2021년) 국민건강영양조사 원시자료를 이용하였다. 국민건강영양조사는 시․도, 동․읍면, 주택유형을 기준으로 층화하고 주거면적 비율, 가구주 학력 비율 등을 층화 기준으로 사용한 다단계 층화집락 표본 추출법을 사용하여 수집되었다. 원시자료는 홈페이지(https://knhanes.kdca.go.kr/knhanes/main.do)에서 사용승인을 받아 사용하였다.
5. 자료 분석
수집된 자료는 SPSS WIN 27.0 프로그램(IBM Corp., Armonk, NY, USA)을 이용하여 통계분석을 실시하였다. 주요 연구변인들은 복합표본 설계 정보인 층화(strata), 집락(cluster), 3개년도 평균 가중치(weight)를 반영하여 통계치를 산출하였다. 복합표본 자료는 무응답인 자료인 경우에도 가중치가 적용되었기 때문에 이러한 자료 특성을 고려하여 결측값은 유효한 값으로 설정하고 분석하였다. 복합표본 분석의 특성을 반영하여 실수는 가중되지 않는 빈도로, 백분율과 평균 및 표준오차는 가중치를 반영하여 산출하였다.
본 연구는 20세 이상의 이상지질혈증 유병자 중 지질관리 취약한 군을 규명하기 위하여 의사결정나무 분석을 이용하였고, 이를 가장 잘 예측하는 변인들의 조합 도출을 위하여 노드 내 동질성의 극대화를 추구하기 위하여 부모마디로부터 자식마디가 2개로 분리되게 하는 Classification and Regression Tree 방법으로 분석하였다[18]. 본 연구에서 모형 설정값은 최대나무 깊이인 분류최대 분할수준 5, 분할될 부모노드 최소 크기 10, 자식노드 최소 크기 5, 향상의 최소 변화량 0.0001, 불순도 측정방법 Gini로 하였고, 가지치기를 시행하였다. 본 연구에서는 지질관리 취약군 모형의 안정성을 평가하기 위하여 구축된 모형예측력을 평가하는 과정을 총 10회 반복하여 평균 위험추정치 10개를 도출하고 이를 전체 자료로 구축한 모형의 위험추정치와 비교하는 10-fold 교차타당성 평가(cross validation)를 실시하였다[21].
6. 윤리적 고려
본 연구는 국민건강영양조사에 참여한 대상자들에 대한 자료를 2차 분석한 연구로서, 공개된 통계자료 이용 전, 통계자료 이용자 준수사항과 보안관련 내용에 서약을 한 후 개인식별 정보가 포함되지 않는 가상의 번호로 분류된 원시자료를 제공받았기에 대상자의 익명성과 기밀성이 보장되었다. 본 연구수행 전, 전북대학교 생명윤리심의위원회에서 심의면제 승인을 받은 후 연구를 진행하였다(JBNU 2023-04-009).
연구 결과
1. 대상자의 인구사회학적 및 질병관련 특성
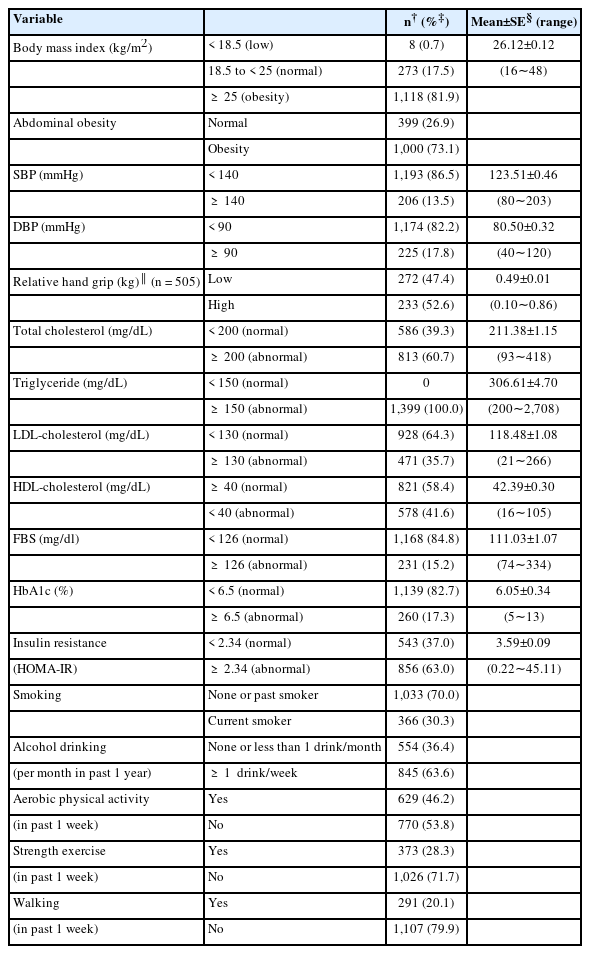
대상자의 인구사회학적 특성 중 평균 연령은 48.68±0.43세였으며, 대상자의 71.1%가 여성이었다. 학력은 고졸 미만이 54.9%이었고, 소득수준은 ‘중’이라고 응답한 대상자가 49.7%이었다. 직업이 있는 대상자는 66.5%이었다. 질병관련 특성으로는 대상자 중 이상지질혈증 미인지군은 78.1%, 이상지질혈증 치료를 받고 있는 대상자는 21.9%였으며, 이상지질혈증 치료를 받고 있는 대상자 중 약물복용 이행군은 41.9%이었다. 본 연구 대상자인 이상지질혈증 유병자 중 이상지질 미조절군에 속하는 대상자는 60.8%였다. 고혈압, 당뇨병, 뇌졸중, 심근경색증 혹은 협심증을 진단받은 대상자는 각각 25.5%, 11.2%, 1.0%, 2.1%였다. 주관적으로 건강상태를 ‘보통’으로 인식한 대상자는 53.7%, 스트레스를 높게 인지하고 있는 대상자는 29.4%였다(Table 1).
2. 대상자의 생리적 지표 및 건강행태 특성
대상자의 생리적 지표 중 평균 체질량지수는 26.12±0.12 kg/m2이었으며, 비만군이 81.9%이었고, 복부비만군은 73.1%였다. 수축기 혈압은 평균 123.50±0.46 mmHg으로 140 mmHg 이상이 13.5%이었으며, 이완기 혈압은 평균 80.50±0.32 mmHg으로 90 mmHg 이상인 대상자는 17.8%이었다. 상대악력은 평균 0.49±0.01 kg이었고, 악력이 낮은 군은 47.4%이었다. TC 평균은 211.38±1.15 mg/dL으로 비정상군(≥ 200 mg/dL)은 60.7%이었다. TG 평균은 306.61±4.70 mg/dL이었고, 비정상군(≥150 mg/dL)은 100%이었다. LDL-C 평균 118.48±1.08 mg/dL이었고, 비정상군(≥130 mg/dL)은 35.7%이었으며, HDL-C 평균 42.39±0.30 mg/dL이었고, 비정상군(< 40 mg/dL)은 41.6%이었다. 대상자의 평균 공복혈당은 111.03±1.07 mg/dL이었고, 비정상군(≥ 126 mg/dL)은 15.2%이었으며, 평균 HbA1c는 6.05±0.34%로, 비정상 당화혈색소군(≥ 6.5%)은 17.3%이었다. HOMA-IR은 3.59±0.09이었고, 비정상군(≥ 2.34)은 63.0%이었다(Table 2).
대상자의 건강행태 중 현재 흡연을 하고 있는 대상자는 70.0%이었고, 1개월 이내 1잔 이상의 음주를 하고 있는 대상자는 63.6%로 나타났다. 신체활동 양상 중 유산소운동 실천군은 46.2%, 근력운동 실천군은 28.3%, 걷기운동 실천군은 20.1%이었다(Table 2).
3. 이상지질관리 취약군 특성
본 연구에서는 이상지질혈증 유병자의 지질관리 취약군을 규명하기 위하여 의사결정나무 분석을 실시하였다. 대상자의 인구사회학적 및 질병관련 특성, 생리적 지표, 건강관련 특성의 총 31개의 변수를 지질관리 취약군의 예측변수로 투입하였다(Figure 1-A, Figure 1-B). 분석 결과, 끝 노드의 수는 총 22개로 산출되었고, 전체 대상자로 구성된 뿌리노드에서 이상지질 미조절군은 58.2%(814명)으로 나타났다. 본 연구에서 ‘지질관리 취약군’은 이상지질혈증 유병자 중 혈중 지질관리를 잘 하지 못해 목표 혈중 지질농도에 이르지 못한 군으로 해석할 수 있으며, 의사결정나무 분석 모형에서 도출된 21개 끝 노드들 중 뿌리노드의 이상지질 미조절군인 58.2%보다 높은 노드로 정의하였다.

(A) Decision-tree model to identify poor lipid control group among patients with dyslipidemias (Left side of the full decision-tree model). (B) Decision-tree model to identify poor lipid control group among patients with dyslipidemias (Right side of the full decision-tree model).
분석결과, 지질관리 취약군은 7개로 규명되었으며(Table 3), 지질관리 취약군에 대한 의사결정나무 분지를 형성한 예측요인들은 총 12개로, 성별, 연령, 교육수준, 이상지질혈증 약물복용 이행 여부, 이상지질혈증 인지 여부, 심근경색 혹은 협심증 진단 여부, 당뇨병 진단 여부, 주관적 건강상태, 상대악력, HbA1c, 유산소운동 실천 여부, 걷기 실천 여부였다.
구체적으로 지질관리가 가장 안 되고 있는 첫 번째 지질관리 취약군(노드 30)은 이상지질혈증 약물복용 미이행자이면서, 당뇨병 미진단자이고, 낮은 상대악력을 가지면서, 49세 이상 여자인 그룹으로 대상자는 79.1%이였다. 두 번째 지질관리 취약군(노드 17)은 약물복용 미이행자이면서 당뇨병 미진단자이고, 높은 상대악력을 가지면서, 53세 미만인 그룹으로 대상자가 71.2%이었다. 세 번째 지질관리 취약군(노드 40)은 약물복용 이행자이면서, 이상지질혈증에 대한 질병인지가 있고, 60세 미만이면서, 주관적 건강상태를 보통으로 인식하고 유산소운동 미실천군인 그룹으로 대상자가 70.0%이었다. 네 번째 지질관리 취약군(노드 34)은 약물복용 미이행자이면서 당뇨병 미진단자이고, 높은 상대악력을 가지면서 53세 이상, 대학교 이상 졸업자인 그룹으로 대상자가 68.3%이었다. 다섯 번째 지질관리 취약군(노드 27)은 약물복용 미이행자이면서 당뇨병 미진단자이고, 낮은 상대악력을 가지면서 49세 미만이고 질병미인지 그룹으로 대상자가 65.4%이었다. 여섯 번째 지질관리 취약군(노드 20)은 약물복용 미이행자이면 당뇨병 진단자이고, 걷기운동 미실천자이면서 HbA1c가 6.5% 이상인 그룹으로 대상자가 63.6%이었다. 일곱 번째 지질관리 취약군(노드 36)은 약물복용 이행자이면서 질병인지가 있고, 심근경색증 혹은 협심증 미진단자이면서 낮은 상대악력을 가지고 있고 여자인 그룹으로 대상자가 62.0%이었다.
본 연구에서는 지질관리 취약군 규명을 위하여 구축된 모형의 위험추정값은 .30이었고, 10-fold 교차타당성 검증하여 계산된 평균 위험추정값은 .36로 거의 차이를 보이지 않아서 본 연구 구축모형의 안정성은 확보되었다. 실제 이상지질 미조절자인 대상자 814명 중에서, 본 의사결정모형이 지질관리 취약군으로 예측한 대상자는 744명으로, 본 모형의 민감도(sensitivity)는 91.4%이었다.
논의
본 연구는 제8기 국민건강영양조사 자료(2019~2021년)를 기반으로 20세 이상의 이상지질혈증 유병자의 특성과 건강행태 및 지질관리 실태를 파악하였으며, 국내외 처음으로 의사결정나무 분석기법을 이용하여 이상지질혈증 유병자 중 지질관리 취약군을 규명하고자 하였다.
본 연구결과 20세 이상의 전체 1,399명의 이상지질혈증 유병자 중 21.9%만이 질병에 대해 인지하고 있었고, 39.2%의 대상자만이 지질을 잘 조절하는 것으로 나타났다. 또한, 본 연구대상자 중 약물복용 이행에 응답한 대상자 중 41.9%가 지질강하제를 복용하고 있다고 하였는데, 전체 이상지질혈증 유병자를 대상으로 하였을 때, 본 연구에서 약물복용 이행자는 약 14%에 불과하였다. 이러한 결과는 국외 연구에서 보고된 이상지질혈증 인지율 64%와 치료율 18.9%보다 낮았고[22], 조절율 또한 79.5%로 보고된 것에 비하여[8] 본 연구결과는 낮은 수치를 나타내고 있다. 즉, 이는 우리나라 20세 이상의 성인 대상자에서 본인이 이상지질혈증 유병자임에도 불구하고, 질병에 대한 지각이 없다는 점과 이에 따라 적극적으로 지질관리에 참여하지 않는 환자들이 많다는 것을 의미한다. 특히 우리나라의 경우 고콜레스테롤혈증과 고LDL-C 유병자가 점차적으로 증가하고 있고 이는 이상지질혈증이 심혈관계질환 발생 위험률을 높이는 것으로 밝혀져 있는 바[1,2] 유병자 스스로 본인이 이상지질혈증에 대한 인지를 높이고, 정기적인 건강검진 등을 통해서 지질 수치를 확인할 필요가 있다. 이를 위하여 국가 혹은 지역사회 내에서 이상지질혈증 선별검사 필요성, 발병 예방 혹은 지질관리의 중요성 등에 대한 내용을 모바일 혹은 웹 기반 등의 다양한 방법을 통해서 적극적으로 홍보해야 한다는 점과 이상지질혈증 환자를 위하여 심혈관계 질환 발병 위험성, 지질 임상지표 심각성을 고려한 맞춤형 교육프로그램 개발이 필요하다는 것을 시사하고 있다.
본 연구결과 대상자의 생리적 지표와 건강행태를 분석하였을 때, 대다수의 이상지질혈증 유병자가 비만(81.9%)과 복부비만(73.1%)이 있는 대상자 비율이 높았는데 이는 비만이 이상지질혈증과 밀접한 관련성이 있다는 선행연구 결과[9,23]들을 지지하고 있고, 이상지질혈증 관리 측면에서 비만 관리에 초점을 두어야 함을 보여주고 있다. 더 나아가, 비만은 인슐린 저항성과 염증반응을 높이는 반응을 고려할 때[23] 이상지질혈증 유병자 대상의 혈당관리 또한 중요한 부분임을 보여주고 있다[24]. 또한, 본 연구결과 이상지질혈증별 항목별 분류에서는 대상자 모두가 TG 비정상군(≥ 150 mg/dL)에 속하고, 64.3%는 TC 비정상군(≥ 200 mg/dL), 41.6%가 HDL-C 비정상군(< 40 mg/dL), 35.7%가 LDL-C 비정상군(≥ 130 mg/dL) 순으로 나타났는데, 이는 20세 이상의 성인이 지질혈증 4가지 임상지표에 대한 내용과 이상지질혈증과 심혈관 질환 발생에 미치는 영향 등에 대한 이해가 있어야 하며[25] 지질혈증과 관련된 임상지표 모두를 고려한 환자 중심의 보다 적극적이고 세밀한 지질관리가 필요하다 하겠다.
의사결정나무 분석은 공통의 특성을 가진 집단을 탐색하고, 그들 중 위험요인이나 취약요인을 가진 취약군을 발견하여, 취약군 예측모형을 구축하는데 활용되는 유용한 방법으로서, 간호학 연구에서도 활용되고 있다[26]. 최근 학계에서 빅데이터 활용 연구에서 보다 타당한 결론을 도출하기 위해 관심을 갖는 Machine Learning에서도 분석 알고리즘의 하나로 의사결정나무분석을 활용하고 있으며, Machine Learning의 다양한 알고리즘들 중 의사결정나무분석은 예측성능이 우수할 뿐만 아니라 해석과 설명이 쉽고, 일반화 능력이 뛰어나기 때문에 많이 활용되고 있다[27].
의사결정나무 분석결과, 지질관리 상태에 대한 예측모형은 총 14개의 예측변인들이 분지를 형성하여 총 22개의 그룹을 형성하였고 그 중 이상지질관리 취약군은 총 12개의 예측변인들이 상호조합을 통해 지질관리 취약군을 규명하였다. 의사결정나무에서 주요 분지를 형성하는 변인들은 결과변인에 대한 높은 영향력을 갖기에[26], 이들 변인들의 중요성도 함께 고려해야할 필요가 있다. 본 연구에서 의사결정나무의 첫 번째 분지를 형성한 변수는 이상지질혈증 약물복용 이행 여부였다. 이상지질혈증 약물복용 여부, 즉 복용군과 미복용군에 따라 전체 그룹들이 처음으로 2개의 파트로 분지되었으며, 전체 7개의 이상지질관리 취약군 중 5개 취약군이 이상지질혈증 약물 미복용군에 해당되었다. 이상지질혈증은 약물치료의 조절효과가 높으므로[2,28], 약물복용이 임상적으로 환자에게 미치는 영향과 중요성은 매우 크다. 따라서 이상지질혈증 대상자들의 약물복용 이행을 높이기 위한 간호학적 전략이 마련되어야 하겠다[28,29]. 이 외에도 당뇨병 진단 여부, 악력, 연령, 이상지질혈증 인지 여부, 성별, 교육수준, 걷기, HbA1c, 심근경색증 진단 여부, 주관적 건강상태, 유산소운동 요인들이 지질관리 취약군을 형성하는 유의미한 예측변인들로 제시되었다. 이는 지질관리 예측변인들에 대한 기존 선행연구들과 같은 맥락에서 이해되는 부분도 있지만, 다른 방향을 제시하는 부분도 있어 결과 해석 시 의사결정나무 분석의 특성을 이해하며 해석할 필요가 있다.
본 연구결과 제시된 의사결정나무 분석을 통해 이상지질혈증 유병자의 지질관리 취약군 예측모형의 구체적인 결과는 다음과 같다. 전체 1,399명 중, 전체 대상자로 구성된 뿌리노드에서 이상지질 미조절군은 총 814명으로 전체 대상자의 58.2%에 해당하였으며, 총 7개의 지질관리 취약군이 규명되었다. 이에 이상지질 미조절군의 분포가 많은 상위 취약군들 및 취약군을 구성하는 주요 예측변인들을 중심으로 논의하고자 한다.
먼저, 전체 그룹들 중 이상지질 미조절 대상자의 비율이 79.1%로 가장 높은 그룹은 노드 30이었다. 노드 30은 이상지질혈증 약물복용 미복용자이면서, 당뇨병 미진단자이고, 낮은 상대악력을 가지는 49세 이상 여성들의 그룹이다. 여기서 눈여겨 볼 것은 성별만 다르고 그 외 모든 특성이 동일한 즉, 약물복용 미이행자이면서, 당뇨병 미진단자이고, 낮은 상대악력을 가지는 49세 이상의 남성들의 그룹인 노드 29은 이상지질 미조절군이 54.2%로 비교적 지질조절이 잘 되는 군으로 분류되었다. 즉, 본 의사결정나무 분석결과를 통해 성별과 함께 연령이 조합됨에 따라 같은 조건을 가진 49세 이상의 남성에 비해, 49세 이상의 여성들에서 이상지질 미조절 대상자의 비율이 높음이 규명되었는데, 이러한 결과는 우리나라의 이상지질혈증 유병율에 대한 보고[1]에서 고콜레스테롤혈증 환자 중 30-40대는 남자가 유병률이 높으나, 50세 이후에는 여자가 더 높은 것으로 나타난 것과 같은 맥락에서 이해될 수 있다. 50세 이후 여성에서 이상지질혈증 유병률이 증가하는 것은 여성호르몬, 폐경 등과 관련이 있는데, 폐경은 TC, LDL-C, TG 증가와 관련이 있는 것으로 보고되고 있다[30,31]. 따라서 자연 폐경자이거나 혹은 치료를 위하여 인위적으로 여성호르몬을 낮추어 폐경상태를 유발하는 약물을 복용하는 유방암 환자들과 같은 경우에는 이상지질혈증 발생에 대한 각별한 관심이 요구된다. 특히, 선행연구[32]에서 젊은 유방암 환자들 중에서 이상지질혈증 치료에 대한 약물순응도가 상대적으로 낮은 것으로 보고되고 있으므로, 폐경 여성뿐만이 아니라 유방암 환자와 같은 인위적 폐경자의 지질관리를 위해서는 각각의 차별화된 접근이 마련될 필요가 있다. 연령과 성별 이외에도 제 1순위 취약군인 노드 30의 특성을 구성하는 당뇨병 진단 여부[4]와 악력[13-15]은 선행연구들에서 이상지질혈증과 유의한 관련성이 있는 것으로 제시되고 있는데, 본 연구를 통해 지질관리 취약에도 유의한 영향을 미치는 것을 확인할 수 있었다. 즉, 이상지질혈증 발생은 인슐린 저항성을 높여 당뇨병 발생의 위험을 높일 뿐만이 아니라[32] 당뇨병 환자에서 이상지질혈증의 발생이 증가하기 때문에[4,24] 우리나라 20세 이상의 성인을 대상으로 지질과 혈당의 임상지표 검진 필요성에 대한 홍보가 필요하다. 또한, 악력은 근력을 나타내는 간접적인 지표로 활용되며, 손쉽게 측정 가능하다는 장점이 있는데, 선행연구에도 악력이 낮을수록 이상지질혈증 발생이 높다고 보고된 결과에 근거하여[13,33,34], 악력저하를 나타내는 대상자를 선별하여 이들이 지질관련 지표를 확인하고 근력 강화을 할 수 있도록 운동프로그램 활용 등의 방안을 모색해야 한다.
그리고 노드 30과 세 가지 특성은 동일하나, 그 외 다른 특성인 질병 미인지이면서 49세 미만의 대상자 그룹인 노드 27번은 이상지질 미조절 대상자의 비율이 65.4%로, 전체 7개 취약군 중 미조절 대상자 비율이 다섯 번째로 많았다. 즉, 앞에 논의한 바와 같이 같은 3가지 조건(약물복용 미이행, 당뇨병 미진단자, 낮은 상대악력)이 동일함에도 불구하고, 49세 이상의 여성은 이상지질 조절 취약군 1위였으며(노드 30), 49세 이상의 남성은 이상지질 조절이 잘되는 군이었고(노드 29), 49세 미만인 남성과 여성들에서는 질병에 대한 인지가 없을 때 취약군 5위에 해당되는 노드 27이었다. 반면에 위 3가지 조건이 동일함에도 불구하고 49세 미만인 남성과 여성들이 질병인지를 가지고 있는 노드 28은 이상지질 미조절 대상자의 비율이 22.2% 뿐으로 지질조절이 상대적으로 우수한 그룹에 해당되었다. 이렇게 질병에 대한 인지는 이상지질혈증 약물복용 이행군 노드 2에서도 노드 5와 노드 6으로 두 번째 분지를 형성하는 주요 변인이다. 우리나라의 고콜레스테롤혈증 환자 10명 중 6명은 질환을 인지하지 못하고 있으며, 기존 진단자의 절반 이상은 약물을 복용하고 있지 않는 것으로 보고되고 있다[1]. 따라서 이상지질혈증은 약물치료의 조절효과가 높으므로[1], 대상자들이 질병에 대한 인지를 갖게 하는 것은 약물복용을 잘 하기 위한 선행요인으로서 매우 중요하다. 따라서 병원, 지역사회 등 간호실무현장에 있는 간호사들은 위험요인을 가진 대상자들을 빠르게 선별하여 그들이 진단검사 등을 통해 질환을 인지하고, 생활습관중재, 약물중재 등 질병의 중증도에 따른 적절한 중재와 치료를 제공받을 수 있도록 해야 하겠다.
이상지질혈증 약물복용 미이행군으로부터 분지한 다섯 개의 지질관리 취약군들 중, 앞서 논의한 노드 30과 노드 27은 당뇨병 미진단자들 중 낮은 상대악력을 가진 그룹에서 분지한 반면, 이상지질 미조절군의 비율이 두 번째로 높은 노드 17과 네 번째로 높은 노드 34는 당뇨병 미진단자들 중 상대악력이 높은 그룹으로부터 분지하였다. 그러나 약물복용 미이행, 당뇨병 미진단, 낮은 상대악력을 가진 대상자들 중, 53세를 컷 포인트로 53세 미만 대상자들은 지질관리의 두 번째 취약군이었으며, 53세 이상이면서 대졸 이상의 교육수준을 가진 대상자들은 지질관리의 네 번째 취약군이었다. 이처럼 악력, 연령, 교육수준 등의 변수가 이상지질혈증에 미치는 영향을 변수 개별적으로 접근한 기존 연구들[9,13,14]은 여러 특성을 동시에 갖는 인간의 특성과 행동을 예측하는 데는 한계가 있다. 따라서 이를 보완하기 위하여 다각적인 측면의 특성들을 동시에 통합적으로 적용하여 대상자의 특성과 행동을 탐색하고 예측하는 분석방법이 요구되며, 이러한 측면에서 의사결정나무 분석의 임상적 유용성을 본 연구를 통해 재확인할 수 있다. 또한 의사결정나무 분석은 각 분지마다 유의미한 그룹으로 분지하는 변수의 컷 포인트를 자동으로 분류해 줌으로써, 예를 들어 연령이라는 변수 한 개가 해당되는 각 분지마다 다양하게 49세, 53세, 65세로 다양한 컷 포인트를 제시하여 줌으로써 하나의 동일 변수도 유의미한 결과를 도출하기 위해 다양한 측면에서 분석되는 장점이 있다.
이상지질혈증 약물 미복용군에서 분지한 다섯 개의 이상지질 조절 취약군들 중, 유일하게 노드 20만 당뇨병 진단을 받은 그룹에서 분지하였으며, 구체적으로는 걷기를 미실천하는 HbA1c 6.5% 이상인 그룹으로 이상지질 미조절 대상자가 63.6%이었다. 반면 HbA1c가 6.5% 미만인 것만 다를 뿐 다른 특성들이 노드 20과 동일한 조건의 노드 19의 이상지질 미조절 대상자 비율은 25.0%뿐이었다. 이러한 결과는 당뇨병 환자의 혈당조절 상태 파악에 사용되는 HbA1c 수치[18]를 당뇨병 뿐만 아니라 이상지질혈증 지질관리 취약군을 선별하는 주요 임상지표로 활용할 수 있음을 시사한다. 즉, HbA1c가 비정상인 당뇨병 환자들에서는 이상지질혈증에 대한 면밀한 추가 검사 및 관리에 대한 지속적인 모니터링이 함께 제공될 필요가 있다.
전체 7개의 지질관리 취약군 중 다섯 개 취약군이 이상지질혈증 약물복용 미이행군에 해당된 반면, 두 개는 약물복용 이행군에서 분지되었다. 그 중 세 번째 취약군인 노드 40은 이상지질혈증 유병 인지가 있는 60세 이하의 주관적 건강상태를 보통으로 인식하고, 유산소운동 미실천군인 그룹이었고, 일곱 번째 취약군인 노드 36은 이상지질혈증 유병에 대한 인지가 없는, 심근경색증 혹은 협심증 미진단자이면서, 낮은 상대악력을 가진 여자 그룹이었다. 이 그룹에 속한 대상자들은 약물복용을 잘 하고 있기 때문에 단순히 약물복용 이행여부 만을 사정할 경우 이상지질 조절 취약군 선별에서 누락될 가능성이 높은 그룹들이다. 따라서 약물복용을 잘 하고 있는 대상자들임에도 불구하고 이들 중에서 다양한 특성들이 조합된 이상지질 조절 취약군을 규명해 냈다는 것은 본 연구결과를 통해 도출된 이상 지질 조절 취약군 예측모형 및 선별도구의 임상적 유용성 및 학문적 의의를 명확히 보여준다.
본 연구의 제한점으로는 이상지질혈증 유병자로 정의한 환자들 중 본 연구의 주요변수에 대하여 한 문항이라도 응답하지 않는 환자들은 본 연구대상자에서 제외되었기 때문에 결과 해석에 주의를 기울어야 하며, 횡단적 조사연구로서 대상자들의 연구변수 특성들의 변화 양상을 파악하기 어렵고, 이상지질혈증 유병자의 지질조절에 영향을 줄 것으로 예측되는 대상자의 인구사회학적 및 질병관련 특성을 통제하지 못한 제한점을 가지고 있다. 그럼에도 불구하고 본 연구결과는 이상지질혈증 유병자의 지질관리를 통해 심혈관계 발생 위험을 감소시킬 수 있는 측면에서 이상지질관리 취약군 기초 선별요인 및 취약군 선별예측도구를 제공하였다는데 의의가 있다.
결론
본 연구는 제8기(2019~2021년) 국민건강영양조사 자료를 이용하여 20세 이상의 이상지질혈증 유병자의 지질관리 실태를 확인하고, 의사결정나무 분석법을 이용하여 지질관리 취약군을 규명한 연구이다. 본 연구대상자의 78.1%는 질병에 대한 인지가 없었고, 60.8%의 대상자가 이상지질 미조절군에 포함되어 있어 우리나라 성인을 대상으로 이상지질혈증 인지율을 높이면서, 엄격한 지질관리가 필요함이 확인되었다. 의사결정나무 분석결과 12개의 상호조합된 예측요인들을 통해 7개의 지질관리 취약군이 규명되었다. 본 연구결과는 이상지질혈증 유병자의 지질관리를 위한 전략 수립 시에 인구사회학적 및 질병관련 특성, 생리적 지표, 건강행태의 다양한 상호작용이 여러 측면에서 총체적으로 고려되어야 하는 필요성을 제시한다.
본 연구결과를 통해 다음과 같이 제언하고자 한다. 첫째, 지역사회나 임상의료 현장에서 이상지질혈증 유병자들이 질병에 대해 인지할 수 있도록 간호사가 지질 검사의 필요성을 강조하며 철저한 지질관리를 목표로 연령, 성별, 동반 만성질환 등의 개인의 특성을 고려한 맞춤형 지질관리 전략을 세울 것을 제언한다. 둘째, 지질관리와 관련성이 있지만 본 연구에서 분석되지 않는 영양소 등의 변인들을 포함하여 지질관리 취약군을 예측하는 반복연구를 실시할 것을 제언한다.
Notes
CONFLICT OF INTEREST
Seok Hee Jeong has been an editorial board member of the JKBNS since 2022. However, she was not involved in the review process of this manuscript. Otherwise, there was no conflict of interest.
AUTHORSHIP
HSK and SHJ contributed to the conception and design of this study; HSK collected data; HSK and SHJ performed the statistical analysis and interpretation; HSK and SHJ drafted the manuscript; HSK and SHJ critically revised the manuscript; HSK supervised the whole study process. All authors read and approved the final manuscript.
FUNDING
This research was supported by the “Research Base Construction Fund Support Program” funded by Jeonbuk National University in 2021.