폐절제술을 받은 폐암환자의 영양섭취 상태와 수술 후 폐합병증
Nutritional Intake and Postoperative Pulmonary Complications among Lung Cancer Patients who Underwent Pulmonary Resection
Article information
Abstract
Purpose: The aim of this study was to examine the nutritional intake status of the lung cancer patients who underwent pulmonary resection and to analyze the relationship between the status of the nutritional intake and the occurrence of postoperative pulmonary complications. Methods: This study was a secondary analysis to determine whether the changes in the nutritional intake after surgery were related to pulmonary complications. Data of a total of 89 patients were included in the analysis and the nutritional intake status was confirmed using a 24-hour dietary recall method. The data were analyzed by descriptive statistics, chi-square or Fisher’s exact test, and ANOVA using the SPSS WIN 26.0 program and word clouds were generated using the R software program. Results: Overall, a decrease in the postoperative nutritional intake was observed in the patients who underwent pulmonary resection, except for the intake of fat. The pulmonary complications were identified to be associated with BMI and the presence of comorbidity. Twenty-three out of 74 patients with vitamin E levels below the Estimated Average Requirements developed pulmonary complications after surgery. Conclusion: Lung cancer patients who underwent pulmonary resection generally have difficulty in acquiring appropriate nutritional intake and need balanced nutritional management. Future investigations on the impact of increased vitamin E intake on postoperative pulmonary complications may provide better insight into the relationship between vitamin E intake and pulmonary complication among patients who underwent pulmonary resection.
서 론
1. 연구의 필요성
암환자는 치료하는 과정에서 영양불량에 노출될 가능성이 매우 높으며, 암환자들은 식욕부진이나 소화불량 및 영양분 흡수장애로 영양상태가 불량하고, 영양불량 상태가 지속되면 면역기능의 저하뿐만 아니라 조직 기능에도 악영향을 미칠 수 있다[1,2]. 암환자의 암세포는 생화학적 대사 기능뿐 아니라 에너지 소비나 기초대사율에도 영향을 미치며, 나아가 비타민이나 무기질 농도, 전해질 농도에도 악영향을 초래한다[2,3]. 암세포로 인해 암환자는 영양상태가 악화될 수 있으며, 단백질, 지방, 무기질 등이 부족하여 암 악액질(cancer cachexia) 상태로 발전할 수 있다[3]. 암 악액질 상태는 인간의 생명을 위협하고 근육소모나 체중감소, 미각 변화, 식욕부진, 영양불량 등의 부작용을 야기시킨다[1-3]. 결국 암환자들의 영양불량은 해당 질병을 악화시키거나 합병증의 주요 원인이 될 뿐만 아니라 생존기간에도 영향을 미친다[3].
암환자뿐만 아니라 외과적 수술을 받은 환자에서도 약 35.0-60.0%가 수술 후 영양부족 상태가 나타나며[4,5], 영양이 불량한 수술환자는 수술 후 합병증 발생 가능성이 증가하고, 영양상태가 불량한 환자는 영양상태가 양호한 환자에 비해 1.35배 정도 평균 재원기간이 증가하는 것으로 보고된다[6]. 암환자와 외과적 수술환자의 영양부족 상태가 지속되면 수술 후 합병증 발생, 회복속도의 지연, 감염 발생률이나 사망률 등이 증가하여, 환자의 회복이 지연되고, 이로 인해 의료비 역시 증가하여 경제적인 부담을 증가시킨다[2,4]. 외과적 수술환자의 수술 전·후 면밀한 영양학적 평가는 수술 경과를 향상시키고 합병증 예방에도 도움이 되는 것으로 나타났다[3,7].
폐암의 외과적 치료 방법으로 시행되는 폐절제술은 폐포 환기, 폐활량, 기능적 잔기량의 감소를 유발할 수 있으며 이는 폐합병증을 초래하기도 한다[2,8]. 폐합병증은 폐절제술을 받은 폐암환자에게 가장 흔한 합병증이며 폐기능 저하로 인한 무기폐, 폐렴 등이 흔하게 나타난다[7,9]. 폐합병증 발생과 관련된 위험요인 중 하나로 수술환자의 영양불량이 보고되었으며 영양이 불량한 상태에서 수술환자들은 폐렴 등의 합병증에 걸릴 가능성이 높다[4,5].
폐절제술 후 폐암환자는 폐 일부를 절개하여 수술 전의 호흡기능을 유지하기 위해서는 더 많은 에너지가 요구되나, 폐절제술을 받은 환자는 수술로 인하여 식사에 어려움을 겪는다[2,3]. 폐절제술을 받은 폐암환자 중 저체중 환자 혹은 영양실조에 걸린 환자들이 면역결핍과 호흡기 근육이 약해져 영양실조에 걸린 환자들이 그렇지 않은 환자에 비해 합병증 발생이 증가하는 것으로 나타났다[4]. 또한 폐절제술을 받은 폐암환자의 영양섭취 상태가 낮을수록 합병증이 더 많이 발생하는 것으로 나타났으며[3,10], 폐절제술을 받은 환자들 중 영양관리를 잘한 그룹이 관리가 잘 되지 않은 그룹보다 합병증 발생률이 약 3배 높은 것으로 보고되었다[11].
이상 살펴본 바와 같이 암환자에게서 영양섭취는 합병증 발생과 관련이 있음에도 불구하고 암환자들의 영양섭취 상태는 일반인에 비해 불량한 것으로 보고된다[4]. 수술환자에게 영양섭취는 중요한 문제이며 수술 후 영양불량은 환자의 예후에 악영향을 미칠 수 있으며, 특히 합병증이나 사망 발생의 위험을 높일 수 있다[3]. 영양지원이 포함된 재활프로그램은 폐절제술을 받은 폐암환자의 폐합병증 발생 위험을 낮추고 환자의 회복률을 높이는 것으로 보고된다[3,11]. 그러므로 폐절제술을 받은 폐암환자의 폐합병증을 예방하기 위해 수술 후의 영양섭취 상태에 대한 관리가 필요하다.
국내 다수 연구들은 폐절제술을 시행 받은 환자들의 폐합병증의 위험요인에 대한 연구[8,12], 폐합병증 예방에 관한 중재연구[13,14], 폐암환자의 영양 및 수술환자의 영양 관리[15], 만성폐질환자의 영양상태에 대한 연구[16] 등이었고, 폐절제술을 받은 폐암환자의 영양섭취와 폐합병증과의 관련성에 관한 연구는 부족하였다. 이에 본 연구는 폐절제술을 받은 폐암환자의 영양섭취 상태를 파악하고 영양섭취 상태에 따른 폐합병증 발생유무를 분석하고자 한다.
2. 연구 목적
본 연구의 목적은 폐절제술을 받은 폐암환자의 영양섭취 상태를 파악하고 영양섭취 상태에 따른 폐합병증 발생유무를 분석하는 것이며, 구체적인 목적은 다음과 같다.
폐절제술을 받은 폐암환자의 특성을 파악하고 대상자 특성에 따른 폐합병증 발생유무를 확인한다.
폐절제술을 받은 폐암환자의 영양섭취상태를 파악한다.
폐절제술 전·후의 영양섭취상태에 따른 폐합병증 발생유무를 파악한다.
폐합병증 발생유무에 따른 폐절제술 전·후 영양섭취량의 변화를 파악한다.
폐절제술을 받은 폐암환자의 폐합병증 발생유무에 따른 음식섭취유형을 파악한다.
연구 방법
1. 연구 설계
본 연구는 폐절제술을 받은 폐암환자의 영양섭취 상태를 파악하고 영양섭취 상태에 따른 폐합병증 발생유무를 분석하기 위해 ‘점진적 걷기 운동이 폐절제술 환자의 회복과 장기적 건강결과에 미치 는 효과’[13] 연구에서 수집한 자료를 이차적으로 분석한 이차 자료 분석연구이다.
2. 연구 대상
본 연구에서 이용한 모 연구의 대상자는 40세 이상 80세 미만의 폐암 진단 하에 폐절제술을 위해 입원한 자였으며, 설문지 내용의 이해 및 의사소통이 가능하고 휠체어나 보조기구 없이도 30분 이상 두 발 보행이 가능한 자들이다.
3. 연구 도구
1) 대상자 특성
대상자 특성은 연령, 성별, 배우자 유무, 학력, 직업유무, 총 월소득, 규칙적 운동 유무, 신체활동 수준, 흡연유무, 체질량지수(Body Mass Index, BMI) 등의 일반적 특성과 폐절제 범위, 동반질환(만성폐쇄성폐질환, 고혈압, 당뇨, 심장질환 등) 유무, 동반질환 수, 폐기능 등의 질병 관련 특성에 대한 항목들을 본 연구에서 이용하였다.
2) 영양섭취상태
영양섭취 상태는 한국영양학회 영양정보센터에서 제작한 CAN-pro 4.0 프로그램으로 섭취량을 계산 및 기록하여 대상자들의 1일 영양소섭취량을 산출하였다. 자료는 선행연구[15]를 참고하여 24시간 식이 회상법을 적용하였으며, 간호학 석·박사 과정생으로 구성된 연구보조원들이 환자가 기억하는 수술 전날(가정식) 및 수술 한달 후(가정식)의 영양섭취 상태를 확인하였다. 자료수집가는 섭취한 식사량을 회상하는데 도움을 주기 위해 식품 모형을 제시하여 조사 대상자가 섭취한 식품의 양을 기억하는데 도움을 주어 자료의 신뢰성을 더하였다. 총칼로리는 추정에너지요구량(Estimated Energy Requirement, EER)을 기준으로, 단백질은 권장 단백질 섭취량 0.8 kg/day을 기준으로, 비타민 A, C, E 및 무기질(칼슘, 인)은 추정평균요구량(Estimated Average Requirement, EAR)을 기준으로, 비타민 D는 충분섭취량(Adequate Intake, AI)을 기준으로 섭취 기준을 충족하지 못한 대상자의 비율을 구하였다. 한국영양학회에서 제시한 한국인 영양소 섭취기준[17]과 암환자에게 중요한 영양소를 중심으로[18] 총 칼로리와 탄수화물, 단백질, 지방 및 비타민(A, C, E), 무기질(칼슘, 인)을 분석하였다.
3) 수술 후 폐합병증
폐합병증은 폐절제술 후 가장 흔한 합병증이며, 주로 폐렴과 무기폐가 가장 일반적으로 나타나는 폐합병증으로 보고한 선행연구[19]를 근거로 본 연구에서는 폐합병증으로 폐렴과 무기폐를 포함하였다. 폐합병증은 수술 후 한 달 이내 영상의학과 전문의가 판독한 영상 판독결과지와 흉부외과 전문의에 의해 작성된 경과기록지 및 간호기록지를 통해 폐렴과 무기폐 발생 유무로 확인하였다.
4. 자료 수집
매주 흉부외과 외래를 통해 폐절제술을 위해 입원하는 대상자를 확인하여 수술 전날 병실을 방문하여 연구의 목적과 방법에 대해 설명하고 동의한 자에 한해 1차 자료수집을 진행하였으며, 2차 자료수집은 수술 후 1개월 후 외래 방문 시 일대일 면담으로 이루어졌다. 사전조사와 중재 1개월 후 조사에 참여한 89명의 자료를 활용하였고 본 연구의 분석에 포함된 대상자 중 중재군은 50명, 대조군은 39명이었다.
5. 자료 분석
수집된 자료는 SPSS WIN 26.0 및 R-project를 이용하여 분석하였다.
대상자의 특성은 빈도와 백분율, 평균과 표준편차로 확인하였고 대상자 특성에 따른 폐합병증 발생유무는 χ2 test, t-test, Fisher’s exact test로 분석하였다.
대상자의 수술 전·후 영양섭취 상태는 빈도와 백분율, 평균과 표준편차로 파악하였다.
폐절제술 전·후의 영양섭취상태에 따른 폐합병증 발생유무는 χ2 test와 Fisher’s exact test로 분석하였다.
폐합병증 발생 유무에 따른 폐절제술 전·후의 영양섭취변화는 중재군과 대조군의 그룹효과를 통제변수로 포함하여 ANCOVA로 분석하였다.
대상자의 폐합병증 발생유무에 따른 음식섭취 유형은 R 소프트웨어 프로그램, 버전 3.5.3을 이용하여 워드클라우드로 분석하여 시각화하였다.
6. 윤리적 고려
본 연구 수행을 위해 환자의 식별 정보가 없는 일련번호로 정리된 SPSS자료를 제공받아 분석하였으며, 자료분석을 위해 P대학교 생명윤리위원회에서 심의면제를 받았다(PNU IRB/2020-27-HR).
연구 결과
1. 대상자의 특성과 폐합병증 발생유무
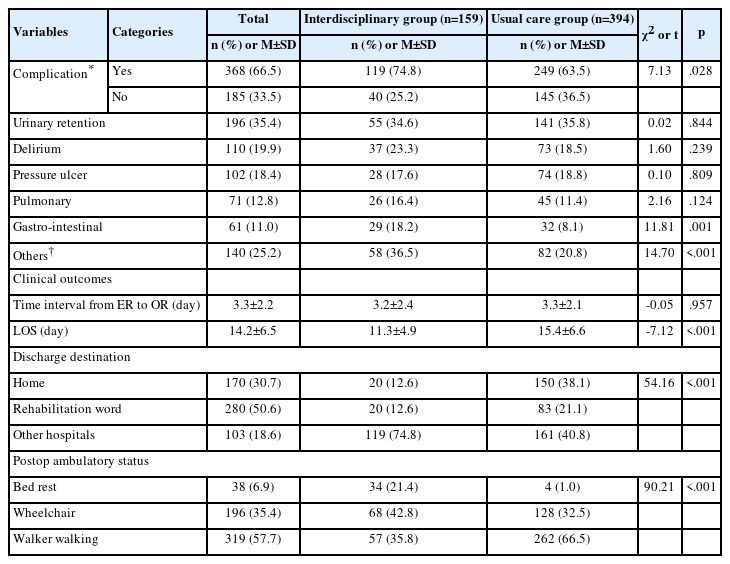
본 연구 대상자의 특성과 특성에 따른 폐합병증 발생유무는 Table 1과 같다. 분석에 포함된 연구대상자는 89명이었고, 대상자의 평균 연령은 64.0세로 65세 미만이 50.6%이었고, 총 참여대상자 중 남 자는 56명(62.9%)으로 여자보다 더 높은 비율을 차지하였다. 대상자 중 ‘배우자가 있는 경우’는 81명(91.0%)이었으며, 교육 정도는 ‘고졸’이 32명(36.0%)이었고, 월수입은 ‘100만 원 미만’이 38명(42.7%)으로 가장 많았다. 규칙적인 운동여부에서 ‘규칙적으로 운동한다’가 73명(82.0%)이었으며, 신체활동에 대해서는 ‘비활동’이 42명(47.2%), 흡연여부는 ‘담배를 전혀 피우지 않았다’가 52명(58.4%)이었으며, ‘과거 흡연 후 현재 금연자’는 37명(41.6%)이었다. 수술은 폐엽절제술이 73.0%로 가장 많았으며, BMI는 평균 23.64로 18.5 이상-25 kg/m2 미만 그룹이 60명(67.4%)으로 18.5 kg/m2 미만이나 25 kg/m2 이상 그룹에 비해 많았다. 대상자 중 동반 질환이 있는 사람은 55명(61.8%)이 었고, 그 중 25명(28.1%)은 동반질환 갯수가 1개였고, 1초간 노력성 호기량의 추정 정상치에 대한 백분율(Forced Expiratory Volume in One Second [FEV1] % predicted)이 60%를 초과하는 대상자가 82명(92.1%)이었다.
Participants’ Characteristics and Occurrence of Pulmonary Complication by Characteristics of the Participants (N=89)
대상자의 특성에 따른 폐합병증 발생유무를 분석한 결과, 연령, 성별, 배우자, 교육정도, 직업유무, 월 총 수입, 규칙적 운동, 활동성, 흡연에 따른 폐합병증 발생유무의 차이는 없었다(p>.050). BMI (χ2=8.15, p=.013)와 동반질환 유무(χ2=4.40, p=.036)에 따라 폐합병증 발생유무는 통계적으로 유의한 차이가 있었다. 즉, BMI가 18.5 kg/m2 미만일 때 4명 중에 2명(50.0%)에서 폐합병증이 나타났고, BMI가 18.5-25.0 kg/m2일 때는 60명 중에 10명(16.7%)이, 25.0 kg/m2 이상은 25명 중에 11명(44.0%)이 폐합병증이 나타나 정상 BMI일 때보다 과체중 혹은 저체중에서 폐합병증이 많이 발생하였다. 동반질환이 없을 때는 13명(38.2%)에서, 동반질환이 있을 때는 10명(18.2%)에서 폐합병증이 발생하였다. 그 외 수술의 종류, 동반질환의 수, FEV1 % predicted에 따른 폐합병증 발생유무는 차이가 없었다(p>.050).
2. 영양섭취 상태
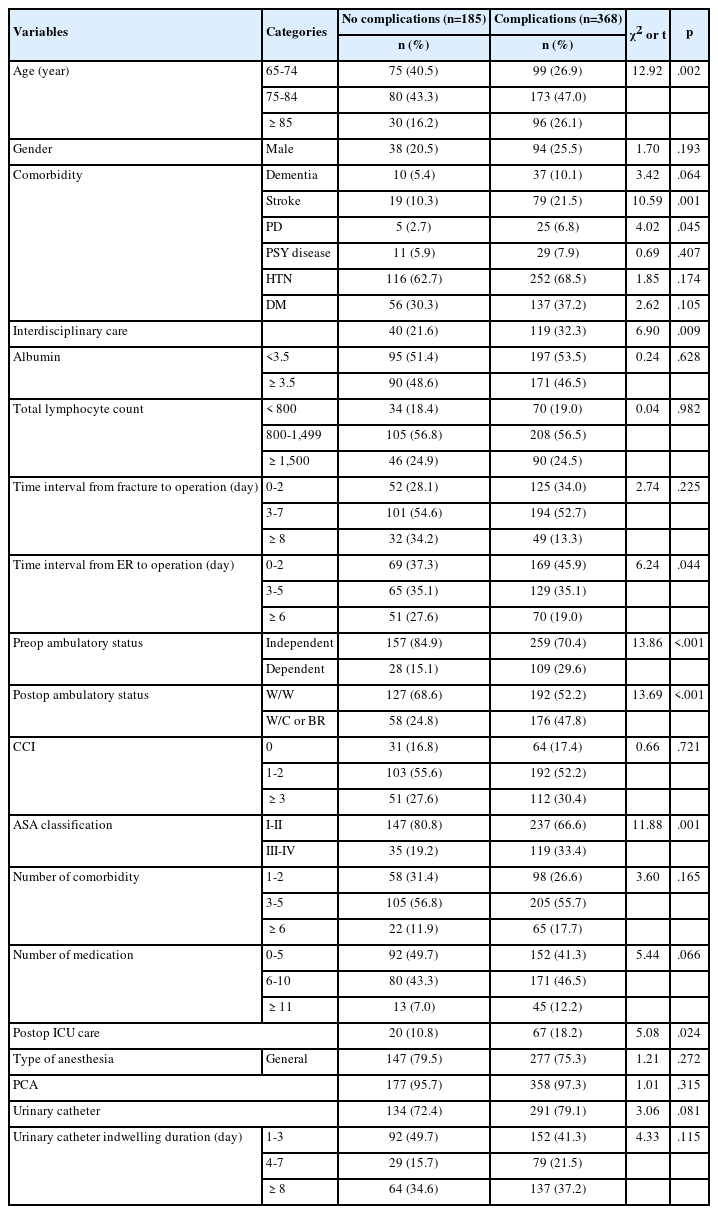
대상자의 영양섭취 상태는 Table 2와 같다. 전체 연구 참여대상자의 수술전날 총 에너지 섭취량은 평균 1,175.28±396.27 kcal에서 수술 후 2,531.08±3,122.94 kcal로 증가하였으며, 한국영양학회에서 제시한 EER 미만은 수술 전 86명(96.6%), 수술 후 65명(73.0%)이었다. 평균 탄수화물 섭취량은 수술 전 205.13±66.44 g, 수술 후 189.93±70.15 g이었고, 권장 탄수화물 섭취비율 55.0% 미만은 수술 전 6명(6.7%), 수술 후 30명(33.7%)이었다. 단백질 섭취량은 수술 전 51.65±25.36 g, 수술 후 45.21±22.80 g이었으며, 권장 단백질 섭취량 0.8 kg/day 미만은 수술 전 51명(57.3%), 수술 후 62명(69.7%)이었다. 지방 섭취량은 수술 전 16.46±14.73 g, 수술 후 176.73±338.85 g이었고, 권장 지방 섭취비율 15.0% 미만은 수술 전 64명(71.9%), 수술 후 52명(58.4%)이었다. 포화지방의 섭취량은 수술 전 5.48±6.41 g, 수술 후 5.25±10.52 g이었고, 허용 포화지방 섭취비율 7.0% 미만은 수술 전 62명(69.7%), 수술 후 79명(88.8%)이었다.
비타민 A 섭취량은 수술 전 541.23±467.93 μg, 수술 후 500.04±562.62 μg이었고, EAR 미만은 수술 전 52명(58.4%), 수술 후 63명(70.8%)이었다. 비타민 C 섭취량은 수술 전 53.84±37.85 mg, 수술 후 41.07±30.33 mg이었고, EAR 미만으로 비타민 C를 섭취한 대상자는 수술 전 71명(79.8%), 수술 후 66명(74.2%)이었다. 비타민 D 섭취량은 수술 전 2.99±4.76 μg, 수술 후 5.17±7.13 μg이었고, AI 미만으로 비타민 D를 섭취한 대상자는 수술 전 86명(96.6%), 수술 후 75명(84.3%)이었다. 비타민 E 섭취량은 수술 전 9.77±5.69 mg, 수술 후 6.52±5.59 mg이었고, EAR 미만으로 비타민 E를 섭취한 대상자는 수술 전 60명(67.4%), 수술 후 74명(83.1%)이었다. 칼슘 섭취량은 수술 전 352.56±206.57 mg, 수술 후 249.92±220.13 mg이었고, EAR 미만의 칼슘을 섭취한 대상자는 수술 전 77명(86.5%), 수술 후 85명(95.5%)이었다. 인 섭취량은 수술 전 801.23±334.38 mg, 수술 후 623.61±358.55 mg이었고, EAR 미만의 인을 섭취한 대상자는 수술 전 24명(27.0%), 수술 후 48명(53.9%)이었다.
3. 폐절제술 전·후 영양섭취상태에 따른 폐합병증 발생유무
폐절제술 전·후 대상자의 영양섭취상태에 따른 폐합병증 발생유무는 Table 2와 같다. 수술 전 영양섭취 상태에 따른 폐합병증 발생유무를 분석한 결과 영양섭취 상태에 따른 폐합병증 발생유무는 유의한 차이가 없었다. 수술 후 영양섭취상태에 따른 폐합병증 발생유무는 비타민 E를 제외하고 유의한 차이가 없었다. 비타민 E 섭취량에 따라 폐합병증 발생유무는 유의한 차이가 있었으며(p=.009), 비타민 E를 EAR 미만으로 섭취하는 대상자 중 합병증이 발생한 대상자는 23명(31.1%), 합병증이 발생하지 않은 대상자는 51명(68.9%)이었고, EAR 이상 섭취한 대상자 중 합병증이 발생한 대상자는 없었고 합병증이 발생하지 않은 대상자는 15명(100.0%)이었다.
4. 폐합병증 발생유무에 따른 폐절제술 전·후 영양섭취량의 변화
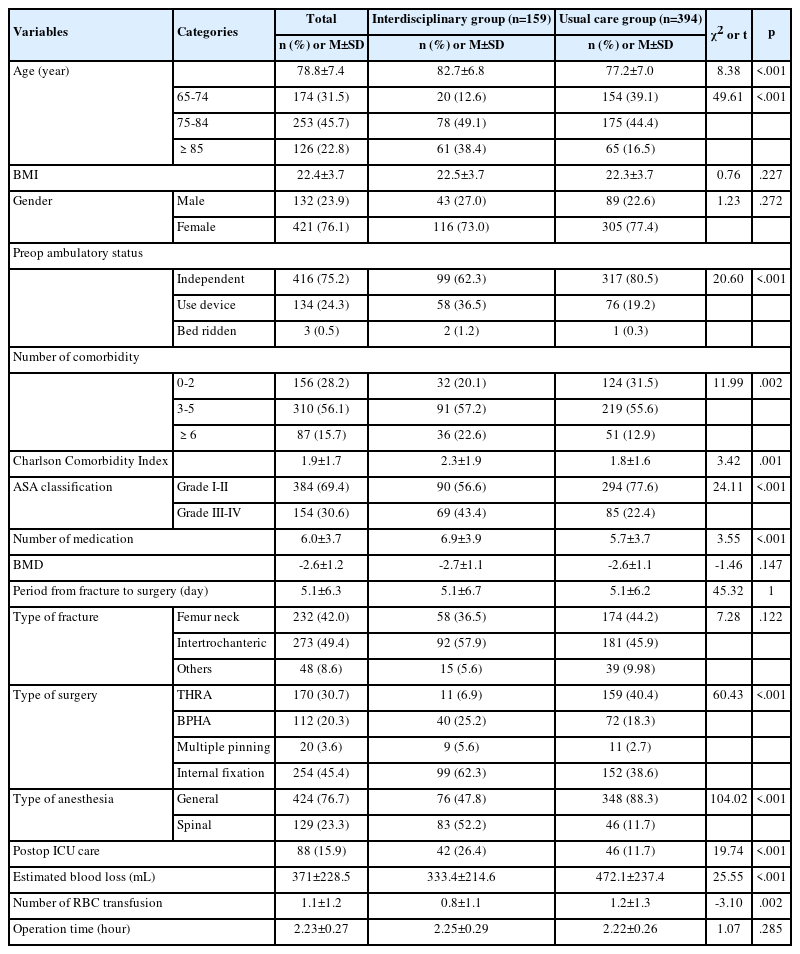
본 연구 대상자의 폐합병증 발생유무에 따른 폐절제술 전·후 영양섭취량의 변화는 Table 3과 같으며 영양섭취상태는 에너지와 지방, 비타민 D를 제외한 대부분의 영양소에서 수술 전에 비해 수술 후에 감소하는 경향이 있었다. 폐합병증 발생유무에 따른 수술 전·후 영양섭취량 변화는 실험군과 대조군의 그룹 효과를 보정하기 위해 그룹을 통제변수로 포함하여 ANCOVA로 분석하였으며, 분석 결과 폐합병증 발생유무에 따라 수술 전·후의 Vitamin E 섭취량 변화에 유의한 차이가 있었다. 수술 전·후 Vitamin E 섭취량의 변화는 폐합병증이 발생하지 않은 대상자는 -2.10±8.74 mg이었고, 폐합병증이 발생한 대상자는 -6.52±6.89 mg이었다(p=.047). 폐합병증 발생유무에 따른 총에너지 섭취량, 탄수화물, 단백질, 지방, 포화지방, 비타민 A, D, 칼슘, 인의 섭취량 변화는 유의한 차이가 없었다(p>.050).
5. 폐합병증 유무에 따른 음식섭취유형의 차이
폐절제술을 받은 폐암환자의 폐합병증 발생유무에 따른 음식섭취유형을 파악하기 위해 섭취한 음식을 시각화하였으며 그 결과는 Figure 1과 같다. 전체 대상자들이 공통적으로 많이 섭취하는 음식은 김치, 잡곡밥이었고 비타민 E를 추정 평균요구량 이상 섭취하는 대상자는 폐합병증이 발생하지 않았으며 주로 김치, 잡곡밥, 시래기, 된장찌개, 김, 현미, 시금치, 콩나물, 브로콜리, 보리밥 등 다양한 음식들을 많이 섭취하는 것으로 나타났다. 비타민 E 섭취량이 EAR 미만인 대상자들의 음식섭취유형은 김치, 잡곡밥, 쌀밥의 비중이 공통적으로 높았다. 비타민 E 섭취량이 추정 평균요구량보다 적었던 대상자들 중 폐합병증이 발생하지 않은 대상자는 폐합병증이 발생한 대상자에 비해 섭취한 음식의 종류가 다양하였다.
논 의
본 연구는 폐암을 진단받은 후 폐절제술을 받은 대상자들의 영양섭취 상태를 파악하고 영양섭취상태에 따른 수술 후 폐합병증 발생유무를 분석하기 위해 수행하였다. 본 연구 참여자는 남성 대상자가 많아 선행연구에서의 대상자 성별분포와 유사하였으며[8,14,20], 비흡연자의 비율은 선행연구에 비해 상대적으로 높았다[8,9]. 이는 본 연구에 참여한 여성 참여자 33명 중 흡연자는 1명으로 여성 참여자의 흡연율이 낮았기 때문인 것으로 생각된다. 일반적으로 폐암의 위험인자는 남성, 연령증가, 낮은 체질량지수, 만성폐쇄성폐질환, 흡연 등이 있으며, 흡연과 폐암과는 상관관계가 높고 폐암환자의 흡연비율이 높은 것으로 보고된다[2,21]. 그러나 여성 폐암환자의 경우 흡연경험과 관련 없이 폐암이 발생할 수 있으며 국립암센터[22] 자료에 따르면 여성 폐암환자의 87.8%는 흡연 경험이 없었던 것으로 보고되었다. 비흡연 여성에서 발생하는 폐암은 취사연료의 유형(전기, 가스, 석유)이나 렌지 후드 사용 유무 등 다른 환경적 요인에 의한 것일 수 있으며[1,2], 이들 요인과 폐암발생과의 관련성에 대한 연구가 활발하게 진행되고 있다[20]. 관련 연구를 바탕으로 다양한 관련 요인에 대한 주의가 요구되며 비흡연 여성을 대상으로 하는 일상생활과 환경에서 발생할 수 있는 폐암 발생요인에 대한 관심과 교육이 필요하다.
본 연구에서는 폐절제술을 받은 폐암환자의 영양섭취 상태를 조사하여 한국인의 영양섭취 권장량을 기준으로 분석하였다. 분석결과 지방을 제외한 모든 영양소에서 수술 전보다 수술 후의 섭취량이 감소하였으며 기준치와 비교하였을 때 권장량보다 낮게 섭취하는 것으로 나타났다. 이처럼 폐암환자의 영양섭취 상태는 일반인의 영양섭취 상태에 비해 매우 낮게 나타났으며 수술 후 영양결핍은 합병증과 사망률의 위험을 높일 수 있다[4,7,23]. 대상자의 영양섭취 상태를 교정함으로써 합병증을 줄일 수 있으며, 합병증을 예방하기 위해서는 대상자의 영양섭취 상태를 일정 기준 이상으로 유지해야 한다[2,15]. 환자들의 영양 불량에 대한 관리가 소홀한 것은 의료진의 영양의 중요성에 대한 인식이 부족하여 영양향상을 위한 중재가 거의 이루어지지 않고, 영양섭취를 보증하기 위한 임상지침이 없기 때문인 것으로 생각된다. 영양불량에 대한 환자, 보호자 및 의료진들의 인식 변화와 정기적 영양 스크린을 통한 문제 발견과 영양교육이 필요하다.
폐절제술을 받은 대상자의 합병증 발생률은 연구결과 마다 차이가 있으며, 본 연구 대상자에서는 폐렴과 무기폐가 가장 일반적인 합병증으로 보고한 선행연구[19]에 근거하여 폐렴과 무기폐만 포함하였으며 폐합병증 발생률은 25.8%이었다. Jeon [20]의 연구에서는 기흉, 수술 후 폐렴, 급성 호흡부전으로 폐 합병증을 정의하였고 폐합병증 발생률은 14.1%이었다. Son과 Kim [8]의 연구에서는 수술 후 발생하는 합병증으로 호흡기계 합병증(수술 후 지속적인 공기누출, 흉수, 폐렴, 호흡부전)과 비호흡기계 합병증(소화기계 합병증, 비뇨기계 합병증, 정신심리적 합병증)으로 분류하여 조사하였고, 보고한 합병증 발생률은 41.9%이었다. 연구대상자의 범위나 합병증의 정의에 따라 합병증 발생률은 차이가 날 수 있는 것으로 보이며 본 연구에서의 폐렴과 무기폐 각각의 발생률은 폐렴 19.1%, 무기폐 12.4%이었고 Jeon [20]의 연구에서 폐렴은 3.6%, 무기폐는 2.1%가 발생하여 본 연구에서의 폐렴과 무기폐 발생률보다 낮았다. Jeon [20]의 연구에 포함된 대상자들은 본 연구에 포함된 대상자들 보다 기저 질환이 있는 비율(43.7% vs 61.8%)과 비흡연자 비율이(41.0% vs 58.4%) 더 낮았으며 이로 인해 폐렴과 무기폐의 발생률이 낮았을 수 있으며 추후 기저질환과 흡연상태 등을 포함한 합병증 발생률에 대한 검토가 필요한 것으로 생각된다.
본 연구에서 폐절제술을 받은 대상자의 특성 중 BMI 지수가 합병증 발생과 관련성이 있는 것으로 나타났으며, BMI 지수가 정상보다 낮을 때와 높을 때 상대적으로 폐합병증 발생률이 높았다. Jeon [20]의 연구에서는 BMI 지수가 낮은 그룹에서 합병증 발생률이 높은 것으로 나타나 저체중 환자를 대상으로 폐합병증 발생 가능성을 줄이기 위해 수술 전 재활과 적극적인 호흡 관련 치료에 영양 프로그램을 추가 적용할 필요가 있다. 비만은 만성폐쇄성폐질환, 천식, 수면 무호흡증 같은 호흡기 질환과 관련이 있으며 폐기능을 악화시킬 수 있으므로[2], 폐절제술 후 합병증을 줄이기 위해 비만환자의 합병증 예방에 특히 주의가 필요하다. 그러나 Jeon [20]의 연구에서는 과체중 대상자의 폐합병증 발생률이 가장 낮아 과체중과 폐합병증 발생과의 관련성에 대한 좀 더 면밀한 탐색이 요구된다.
암환자가 입원할 당시에 영양상태가 좋지 않은 경우, 입원기간 동안 영양상태가 더욱 악화될 가능성이 크며 특히 암환자의 경우 타 질환에 비해 영양불량일 가능성이 크다[4]. 폐암 발생에서 비타민 D 섭취와 폐암 위험의 연관성을 평가하기 위한 12개의 연구를 메타분석 한 결과 비타민 D 섭취와 폐암의 연관성이(RR=0.84, 95% CI 0.78-0.90, p<.001) 보고되었다[24]. 본 연구에서는 비타민 E 섭취량에 따라 폐합병증 발생유무는 차이가 있었고 비타민 E를 EAR 이상으로 섭취하는 대상자는 폐합병증이 발생하지 않았다. 레티놀, 비타민 C 및 비타민 E와 같은 항산화비타민의 섭취량이 증가함에 따라 만성폐쇄성폐질환의 위험도가 감소하였으며[25], 비타민 E와 알파-토코페롤의 혈중농도가 높은 남성은 폐암발생 위험이 낮은 것 으로 나타났고(HR=0.76, 95% CI: 0.66-0.87, p<.001), 비타민 E를 보충했을 때 폐암 위험이 감소한 것으로 나타나(HR=0.74, 95% CI: 0.59-0.91, p=.005), 폐암환자에게 비타민 E 섭취를 장려할 필요가 있다[26]. 항산화비타민과 폐기능과의 연관 가능성은 추측할 수 있으나, 폐절제술을 받은 폐암환자의 영양섭취와 폐합병증 간의 관련성에 대한 연구는 거의 없어 확정적 가설을 제시하기는 어려우며, 추후 폐절제술을 받은 폐암환자의 영양섭취와 폐합병증 발생과의 연관성에 대한 지속적 반복 연구가 요구된다.
본 연구는 폐절제술을 받은 폐암환자들이 비타민 E를 추정 평균요구량 이상 섭취할 경우 폐합병증이 상대적으로 적게 발생할 수 있다는 것을 발견하였다는 점에서 연구의 의의가 있다. 폐절제술을 받은 폐암환자들은 폐절제술 후 탄수화물, 단백질, 비타민, 무기질 등의 섭취량이 수술 전에 비해 감소하였다. 폐절제술 후 충분한 영양섭취는 폐합병증을 감소하는데 도움이 될 것으로 기대된다. 추후 폐절제술을 받은 폐암환자의 영양섭취에 대한 지속적인 모니터링과 장기적인 자료수집을 통해 영양섭취의 추이를 분석하고 영양섭취와 건강회복, 폐합병증 발생 간의 관련성에 대한 장기적 연구가 필요하다. 현재까지 비타민 E에 대한 연구는 만성폐쇄성폐질환 환자에 국한되어 있으며[16,25], 폐절제술을 받은 폐암환자에 대한 연구는 부족하였다.
본 연구결과에서 나타난 폐합병증 발생유무와 비타민 E 섭취량과의 관련성은 폐절제술을 받은 폐암환자의 영양섭취에 대한 계획과 교육에 기초자료를 제공할 것으로 기대되며 EAR 이상의 비타민 E 섭취가 폐합병증 발생을 감소시킬 수 있을지 확인하기 위해 전향적 실험 연구가 필요하다. 본 연구에서 비타민 E의 섭취량이 높은 대상자는 시래기, 시금치와 같은 푸른 잎채소를 많이 섭취하는 경향이 있었다. 푸른 잎채소의 섭취를 강화하는 것과 폐합병증 발생과의 관련성에 대한 추후 연구는 비타민 E와 폐합병증 발생과의 관련성을 확인하기 위해 필요하며, 추후 폐암으로 폐절제술을 받은 대상자의 영양개선을 위한 임상실무개선에 필요한 기초자료를 제공할 것으로 기대된다. 폐절제술 후의 체계적인 영양관리는 폐암환자들의 합병증 관리에 효과적일 수 있다. 영양 상태를 판정하는 방법은 식사섭취조사, 신체계측조사, 생화학적 조사, 임상조사 등이 있으며, 식사섭취조사 방법으로는 24시간 회상법, 식품섭취빈도 조사법, 식사기록법, 식사력 조사법 등이 있고, 각각의 방법에는 장·단점이 있기 때문에 사용 목적에 적합한 방법을 선택해야 한다[27]. Kim과 Chung [28]의 연구에서 면대면 24시간 식사 회상, 사진 앱을 이용한 24시간 식사 회상, 식품섭취빈도 조사지를 이용하여 영양조사를 한 결과, 세 접근에서 나트륨 섭취량에서 유의한 차이가 없어 24시간 회상법의 도구의 타당도가 확인되었다. 한 번의 24시간 회상법으로 평소 영양섭취를 예측하는 것은 한계가 있을 수 있으나 본 연구에서는 수술 전날과 수술 한 달 후 24시간 동안의 식이정보를 기록하여 영양섭취 상태와 폐합병증과의 관계를 분석하였고 음식섭취 현황을 시각화하여 이해도를 높이고 자료의 신뢰도를 향상하려고 노력하였다. 또한, 본 연구에서는 합병증으로 폐렴과 무기폐만 고려하였으나 추후 다양한 합병증 발생과 식이와의 관련성을 조사하는 연구가 필요하다고 하겠다. 본 연구에서 확인된 영양섭취와 폐합병증과의 관련성은 그동안 폐합병증의 위험요인으로써 중요성이 낮았던 영양섭취에 대한 학술적 관심을 높이는데 도움이 될 것으로 생각된다. 본 연구에는 모 연구에서 점진적 걷기운동 중심의 간호중재가 제공된 중재군과 대조군이 모두 포함되었으며, 중재군과 대조군의 영양섭취상태는 사후조사에서 탄수화물 섭취량이 대조군보다 유의하게 감소한 것을 제외하고는 다른 영양소 섭취에는 유의한 차이가 없었다. 본 연구에서는 모 연구에서 제공된 중재의 잠재적 효과를 통제하기 위해 그룹의 효과를 통제변수로 하여 영양소 섭취에 따른 합병증 발생유무를 분석하였으며 본 연구의 결과는 추후 폐절제술을 받은 폐암환자의 영양소 섭취개선을 위해서는 좀 더 집중적인 영양관리가 중재에 포함되어야 함을 나타낸다.
결 론
본 연구는 폐절제술을 받은 폐암환자를 대상으로 영양섭취 상태를 분석하고 영양섭취 상태에 따른 수술 후 폐합병증 발생유무를 분석하였다. 본 연구에 참여한 대상자는 남자가 여자보다 많았고, 일생동안 담배를 전혀 피우지 않았던 대상자에게도 폐암이 발생하여 비흡연자인 경우에도 폐암발생에 주의하여야 함을 알 수 있었다. 폐합병증 발생은 BMI와 동반질환 유무에 따라 통계적으로 유의한 차이가 있어, 평소 건강한 생활습관을 통한 만성질환관리가 중요함을 알 수 있었다. 비타민 E의 수술 전·후 섭취량 차이에 따라 폐합병증 발생의 차이가 있어, 비타민 E를 강화한 식단이 폐절제술을 받은 폐암환자의 폐합병증 발생을 줄이는데 효과적일 수 있으며 이에 대한 추가적 전향적 실험연구가 필요하다.
본 연구에서 관찰된 폐절제술을 받은 폐암환자의 영양섭취와 폐합병증 발생과의 관련성은 그동안 폐절제술 후 발생하는 폐합병증의 위험요인으로써 크게 고려되지 않았던 영양에 대한 학술적 관심을 높이는데 도움이 될 것으로 생각된다. 본 연구의 결과를 토대로 다음과 같이 제언한다. 첫째, 1일 이상의 영양조사와 시각적 자료 혹은 스마트폰 앱 프로그램을 활용한 영양조사를 통해 측정의 타당성과 객관성을 강화한 추후 연구를 제언한다. 둘째, 폐절제술을 받은 폐암환자의 영양섭취 상태에 대한 장기간 추적조사와 회복과 폐합병증 발생과의 연관성에 대한 전향적 연구를 제언한다.
CONFLICTS OF INTEREST
The authors declared no conflict of interest.
AUTHORSHIP
SHL, SKH, DHK, YDK and HL contributed to the conception and design of this study; SHL, DHK and YDK collected data; SHL and HL performed the statistical analysis and interpretation; All authors drafted the manuscript and critically revised the manuscript; DHK, YDK and HL supervised the whole study process. All authors read and approved the final manuscript.