청소년기 동물모델에서 구속 스트레스로 유발된 불안, 우울행동에 미치는 영향
The Alleviating Effects of Sweet Drinks on Restraint Stress-Induced Anxiety and Depressive Behavior in Adolescent Rats
Article information
Abstract
Purpose: Some of the adolescent drinks more sugar-sweetened beverages. However, there is little evidence on the effect of eating behavior on emotional state and neurochemical changes under stress, especially on the levels of typical inhibitory neurotransmitters and gamma-aminobutyric acid. This article demonstrates that sucrose or saccharin drink reduces stress-related behavior responses and GABAergic deficits in adolescent rats. Methods: We randomly assigned 7-weeks-old Sprague-Dawley male rats to three groups: control group (Control), restraint stress only group (Stress), and restraint stress with unrestricted access to saccharin solution (Saccharin) and sucrose solution (Sucrose) as a positive control. We evaluated both anxious and depressive moods using an open field test and forced swim test, respectively. Using western blot analyses, the expression of a GABA-synthesizing enzyme, glutamate decarboxylase-67 (GAD67) and GABAergic markers, including calbindin and parvalbumin was assessed in the prefrontal cortex and the amygdala. Results: We found that both the drinks alleviated anxiety and depressive moods, induced significant attenuation in GAD67 level, and reduced calbindin level under stress in the prefrontal cortex and the amygdala. Conclusion: The results provide an understanding of the effect of sucrose or saccharin drink on stress-related responses. We propose the consumption of sweet drinks as a plausible strategy to alleviate stress-related alterations in adolescents.
서 론
1. 연구의 필요성
많은 청소년들이 일상적으로 가당 음료를 섭취한다[1,2]. 가당 음료는 탄산 음료를 비롯해 설탕이 첨가된 과일 주스와 커피 등을 일컫는다[1]. 청소년이 가당 음료를 자주 섭취하는 데에는 사회경제적 수준과 학업 만족도에 영향을 받을 뿐만 아니라 스트레스가 주요한 역할을 하는 것으로 알려져 있다[3,4]. 스트레스는 뇌하수체-시 상하부-부신 축(hypothalamus-pituitary-adreanl axis, HPA axis)이 활성화를 초래해 혈중 코티솔(cortisol)을 높이고 뇌의 변연계에 활성을 유도한다[5,6]. 그리고 이러한 변화는 단 음식에 대한 갈망을 높이고 식행위를 촉진한다[7,8]. 장기간 단 음식을 섭취하게 되면 청소년 비만 문제로 이어지기 때문에 많은 연구에서는 청소년의 식이요법 교육의 필요성을 제기해왔다[3,4]. 하지만 청소년이 스트레스로 인해 단 음식을 탐하는 것은 스트레스를 완화하기 위한 보상 기전의 작용이기도 하다[8]. 따라서 스트레스로 나타나는 생리적 변화를 적절히 이용하여 부작용 없이 스트레스를 완화할 수 있는 방법에 대한 탐색은 새로운 대안이 될 수 있을 것이다.
스트레스는 무력감, 우울감, 불안감을 증가시키며, 과도한 스트레스가 장기간 지속될 경우 우울증 같은 신경정신학적 질환을 유발하는 원인이 되기도 한다[9,10]. 많은 동물 실험에서 스트레스로 유발된 우울과 불안 행동이 GABA성 신경 세포와 관련이 있다고 보고하였다[11–14]. GABA (gamma-aminobutyric acid)는 중추신경계의 대표적인 억제성 신경전달물질로 글루탐산탈탄산효소-67 (glutamate decarboxylase-67, GAD67)에 의해 글루타메이트(glutamate)로부터 합성된다. 반복적인 스트레스를 가한 실험 쥐의 편도체와 전두엽 피질에는 억제성 신경 신호가 감소할 뿐만 아니라[12-15] GABA의 양을 간접적으로 나타내는 GAD67 역시 감소하는 것으로 알려져 있다[11,16]. GABA성 신경세포의 지표로 이용되는 calcium binding protein 중 parvalbumin은 스트레스로 인해 편도체와 전두엽 피질 부위에서 감소되고[16,17], 대뇌 피질의 흥분-억제 균형(excitation-inhibition balance)을 깨트려 심각한 정신과적 문제를 일으킬 수 있는 것으로 알려져 있다[18]. 더욱이 청소년기는 스트레스 자극에 더 민감하고, 전두엽 피질과 편도체의 발달이 지속되는 시기이기 때문에 스트레스로 인한 손상에 취약하다고 알려져 있다[19,20]. 따라서 적절한 스트레스 완화를 통해 GABA성 신경세포의 안정적인 활성을 유지하는 것이 스트레스로 인한 신경생리학적 변화를 방지하는데 중요할 것이다.
아직까지 스트레스 상태에서 가당 음료를 섭취하는 것이 인체의 중추신경계에 어떻게 영향을 미치는가에 대해서는 보고된 바가 없다. 다만 가당 음료를 섭취한 성인 남성의 fMRI상에서 복측 선조체(ventral striatum)와 편도체가 활성화되는 것으로 나타났다[7]. 유사한 결과가 사카린이 함유된 음료 섭취시에도 확인이 되어 두 물질이 가지는 단 맛이라는 공통된 요인이 중추신경계에 영향을 미칠 수 있다는 가능성이 제기되기도 하였다[7].
사카린은 가장 오래된 인공 감미료이며, 미국 FDA로부터 안정성 승인을 받아 다양한 식품에 첨가물로 사용되고 있다[21]. 흔히 다이어트 음료에 첨가되어 열량은 없지만 설탕처럼 단 맛을 내기 위해 사용된다[21]. 동물 실험을 통해 확인된 사카린 음료의 섭취는 가당 음료와 동일하게 스트레스로 인한 불안과 우울 행동을 완화시키고, 혈중 코르티코스테론(corticosterone) 또한 낮추는 것으로 나타났다[22,23]. 하지만 아직까지 이러한 물질들이 스트레스로 인한 중추신경계에서 나타나는 변화를 어떻게 완화시키는지에 대해서는 충분한 이해가 이루어지지 않았다.
본 연구에서는 단 음료 섭취가 스트레스로 인한 중추신경의 반응에 미치는 효과를 검증하고자 하였다. 편도체와 전두엽 피질은 스트레스로 활성화되는 보상 경로에 포함되면서 동시에 스트레스로 인한 불안과 우울감에 영향을 미치는 부위이기도 하다[24]. 따라서 동물실험을 통해 설탕의 한 종류인 자당과 감미료로 잘 알려진 사카린 섭취가 편도체와 전두엽 피질 부위에 스트레스로 인한 GABA성 신경세포의 변화에 미치는 효과를 살펴보고, 이러한 변화가 우울과 불안 행동을 완화 여부를 확인하고자 한다.
2. 연구목적
본 연구는 청소년기 쥐에 7일간의 구속 스트레스를 적용하여 편도체와 전두엽 피질의 GABA성 신경세포 표지자로서 GAD67, calbindin, parvalbumin을 이용해 이 지표들의 변화와 우울과 불안 행동의 증가 여부를 확인하고자 한다. 그리고 사카린 또는 자당이 첨가된 음료 섭취가 스트레스로 인한 변화를 완화시키는 효과가 있는지 검증하고자 한다.
연구 방법
1. 연구 설계
본 연구는 구속 스트레스를 받은 청소년기 쥐의 행동학적, 뇌신경학적 변화에 사카린 음료와 자당 음료의 섭취가 미치는 효과를 검정한 무작위 대조군 실험연구이다.
2. 연구 대상
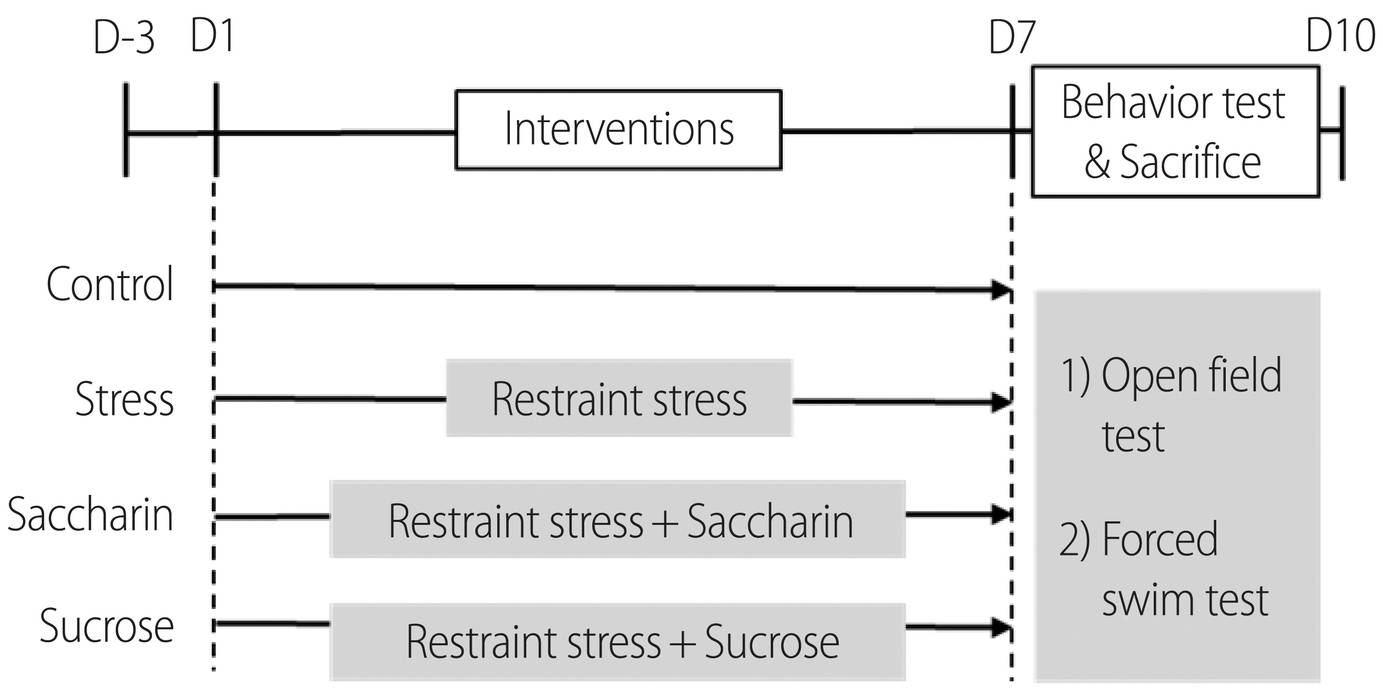
본 연구는 7주령의 Sprague-Dawley (SD)종의 수컷 쥐(오리엔트 바이오, 경기도, 한국)를 실험 대상으로 하였다. 실험의 시작에 앞서 실험 동물이 실험실 사육 환경에 적응할 수 있도록 3일간의 적응 기간을 두었다. 동물 사육 환경은 온도(23±1°C)와 습도(50±2%)가 지정된 변동 범위 안에서 자동 조절되며, 12시간 간격의 낮, 밤 주기가 유지될 수 있도록 하였다. 총 28마리의 쥐는 무작위 표본추출로 대조군(Control, n=7)과 구속 스트레스를 적용한 스트레스군(Stress, n=7), 그리고 구속 스트레스를 적용하고 각각 사카린 음료 또는 자당 음료를 섭취한 군을 사카린 음료군(Saccharin, n=7)과 자당 음료 군(Sucrose, n=7)으로 분류하여 집단간 동일한 개체 수를 배정하였다(Figure 1).본 연구는 S시 소재의 K대학교의 동물 실험 윤리 위원회로부터 연구 계획에 대한 심의를 거쳐 승인을 받았다(KHUASP(SE)-18-058). 또한 연구는 미국 국립보건연구원의 실험 동물 관리와 활용에 대한 가이드라인(NIH Guide for the Care and Use of Laboratory Animals)을 준수하며 진행되었다.
3. 연구 도구
1) 구속 스트레스(restraint stress)
구속 스트레스는 실험 동물의 신체 움직임을 통제해 회피할 수 없는 상황을 구축하여 스트레스를 유발하는 실험 방법이다. 본 연구에서는 선행 연구의 구속 스트레스 모델 구축 방법을 보완하여 적용하였다[23]. 투명 아크릴을 이용해 실험 동물의 전신 움직임을 통제하는 사다리꼴형태의 도구를 제작하였고(지름1=2 cm, 지름2=10 cm, 높이=35 cm), 좁은 면에는 호흡이 가능하도록 통기구를 두었다(Figure 2A). 그리고 매일 2시간씩 7일동안 구속 스트레스를 실험 동물에게 적용하였다.
2) 체중
실험 동물의 체중은 실험 시작 첫째 날과 마지막 날에 구속 스트레스를 적용하기에 앞서 전자 체중계를 이용하여 측정하였다.
3) 사카린 음료(saccharin water)
사카린 음료는 사카린(JMC, Ulsan, Korea)을 0.1%의 농도로 물에 희석한 것으로, 사카린 음료군에게 제공되었다. 사카린 음료는 선행 연구를 바탕으로 실험 동물이 단 맛을 감지할 수 있고, 물을 대체하여도 무해한 농도로 선정하였다[23,25,26]. 해당 그룹의 쥐에게 7일의 실험기간 동안 구속 스트레스를 적용하는 시간을 제외하고, 사카린 음료를 자유롭게 섭취할 수 있도록 하였다.
4) 자당 음료(sucrose water)
자당 음료는 하얀 설탕(CJ CheilJedang Corp., Seoul, Korea)을 1%의 농도로 물에 희석하여 제조하였다. 자당 음료의 농도는 실험 동물이 단 맛을 느끼고 탐지할 수 있고, 사카린 음료의 농도와 비교하여 섭취량의 차이가 나타나지 않는 농도로 하였다[26,27]. 자당 음료는 자당 음료군에게만 제공되었으며, 제공 방식은 사카린 음료군과 동일하게 하였다.
5) 사료 및 음료 섭취량
사료와 음료는 매일 같은 양으로 충분하게 공급되었다. 연구자는 매일 같은 시간에 사료와 음료의 잔량을 측정하여, 직전일의 배급량과 당일의 잔량의 차이를 섭취량으로 기록하였다.
6) 개방장소 탐색활동도 검사(Open field test)
개방장소 탐색활동도 검사는 측정 기구에서 실험 동물의 활동을 관찰하여 불안 정도를 측정하는 행동 실험이다[28]. 실험 기구는 바닥면이 정사각형인 나무 상자(77, 77, 25 cm)로 가로면과 세로면을 각각 4등분하여 총 16개의 동일한 크기의 가상 구간으로 나눠졌다(Figure 2B). 실험 시작에 앞서 기구가 놓인 실험 공간에 실험 동물이 적응할 수 있도록 1시간의 시간 간격을 두었고, 마찬가지로 실험 기구 안에 옮겨진 실험 동물이 공간에 적응할 수 있도록 1분의 간격을 두고 활동을 관찰하였다. 실험 기구 내 탐색활동은 총 5분간 관찰되었고, 보행활동도(locomotion)와 일어서기(rearing)의 횟수를 기록하였다. 보행활동도는 동물들의 활동 감소로 불안정도를 확인하는 실험으로 실험 동물이 실험 기구내 16개의 가상 구간을 이동한 횟수이며, 네 발이 모두 이동되었을 때 1회로 간주하였다. 일어서기는 주변에 대한 호기심과 탐색 정도를 보는 실험으로 실험 동물이 뒷다리로 지탱하며 상체를 들어올리는 행동을 의미하며, 두 앞발이 지면에서 떨어진 경우를 기록하였다. 보행활동도와 일어서기 횟수의 상대적 감소는 실험 동물의 불안감의 증가를 나타낸다[28].
7) 강제 수영 검사(Forced swim test)
강제 수영 검사는 물이 담긴 수조에 실험 동물을 강제로 빠트려 움직임을 관찰하는 행동 실험으로 주로 우울 상태를 확인하기 위해 사용된다[29]. 실험에는 투명한 아크릴로 제작된 원통형 수조( 30 100 cm)를 이용하였으며, 적정 수온의 물(22±2°C)을 수조 높이의 60%까지 채워 준비하였다(Figure 2). 실험은 이틀간 진행되고 첫 날은 훈련 기간으로 실험 동물을 10분간 수조 속에서 자유롭게 헤엄치도록 한다. 다음 날은 실측 기간으로 전일과 동일한 방법으로 수조 속에 옮겨 두고, 5분간의 움직임을 비디오 장치를 이용하여 녹화하며 부동 시간(immobility time)을 측정하였다. 부동은 실험 동물이 수조 안에서 움직임 없이 물 위로 코만 내놓은 채 떠있는 상태를 의미하며, 관찰 기간 동안에 이러한 상태로 유지된 시간의 합을 부동 시간이라 한다[29]. 이는 우울감과 절망감을 반영하는 행동으로 우울감이 심할수록 부동 시간이 길게 나타난다.
8) 혈중 코르티코스테론(corticosterone) 검사
본 연구에서는 혈중 코르티코스테론 농도를 측정하기 위하여 실험 종결시점에 실험 동물을 마취시킨 후 심장 천자로 혈액을 채취하였다. 혈액은 EDTA가 담긴 검체 용기에 담겨 원심분리기에 13,000xg에서 20분간 처리되었고, 상층액만 모아 분석 전까지 -70°C의 냉동고에 보관하였다. 코르티코스테론 농도는 Enzo corticosterone ELISA kit (Enzo Life sciences, NY, USA)를 이용해 제조사의 분석 지침을 준수하며 측정되었다. 코르티코스테론의 기준 농도 곡선과 채취한 혈액 샘플의 농도는 흡광도 405 nm에서 측정되었고, 1 mL당 ng으로 기록하였다.
9) 웨스턴 블롯(Western blotting)
행동 실험 후 실험 동물에 에틸 에테르(덕산약품공업, 경기도, 한국)로 흡입마취를 하고 뇌를 적출하였다. 뇌조직은 분리하여 전두엽 피질(prefrontal cortex)과 편도체(amygdala)을 구분하여 검체통에 옮겨 담았다. 각 조직은 용해 완충액(RIPA lysis buffer; Elpis biotech, Daejeon, Korea)과 단백질 가수분해 효소 억제제(Thermo Fisher scientific, MA, USA)를 첨가하여 균질화하고, 원심 분리하였다. 용해된 단백질이 포함된 상층액을 1차 항체의 종류에 따라 5 μg 또는 10 μg의 일정한 양으로 정량화 하였다. 단백질은 8-15% 나트륨 도데실 황산염 폴리아크릴아미드 겔 전기 이동(sodium dodecylsulfate polyacrylamide gel electrophoresis)을 통해 무게에 따라 분리되었고, 폴리비닐리덴(polyvinylidene difluoride, PVDF; Merch Millipore, Darmstadt, Germany)막 위로 옮겨졌다. 단백질이 옮겨진 막을 5% 탈지 분유 용액을 이용하여 표적 외 부위의 반응을 차단시켰다. 각각의 막은 1차 항체인 GAD67 (1:5,000, Abcam, MA, USA), calbindin(1:15,000, Abcam, MA, USA), parvalbumin (1:15,000, Abcam, MA, USA), beta-actin (1:15,000, Sigma Aldrich, MS, USA)이 용해된 용액에 담겨 4°C에서 하룻밤 동안 반응이 유도되었다. 이어서 Horseradish Peroxidase와 결합된 2차 항체인 anti-rabbit antibody (1:10,000, Enzo Life Sciences, Farmingdale, USA) 또는 anti-mouse antibody (1:10,000, Enzo Life Sciences, Farmingdale, USA)과 실온에서 2시간 반응하도록 한 뒤 화학발광 시약(enhanced chemiluminescence reagent, ECL)을 이용하여 x-ray 필름에 인화하였다. 표적 단백질의 발현양에 대한 비교는 Image J 1.8.0 (U.S. national Institutes of Health, MD, USA)을 이용하여 수행하였다. Beta-actin은 총 단백질에 대한 대조군으로 사용되었다.
4. 자료 분석 방법
본 연구의 실험 결과는 SPSS 24.0 프로그램을 이용하여 분석하였고, 결과값은 평균과 표준오차로 표기하였다. 실험 동물의 사카린 음료와 자당 음료 섭취 효과를 검증하기 위하여 ANOVA를 이용하여 분석하였고, 사후검정으로는 Tukey를 이용하였다. 모든 통계 검정의 유의수준은 .05 미만을 기준으로 하였다.
연구 결과
1. 그룹별 체중 및 일 평균 사료 섭취량과 음수량의 비교
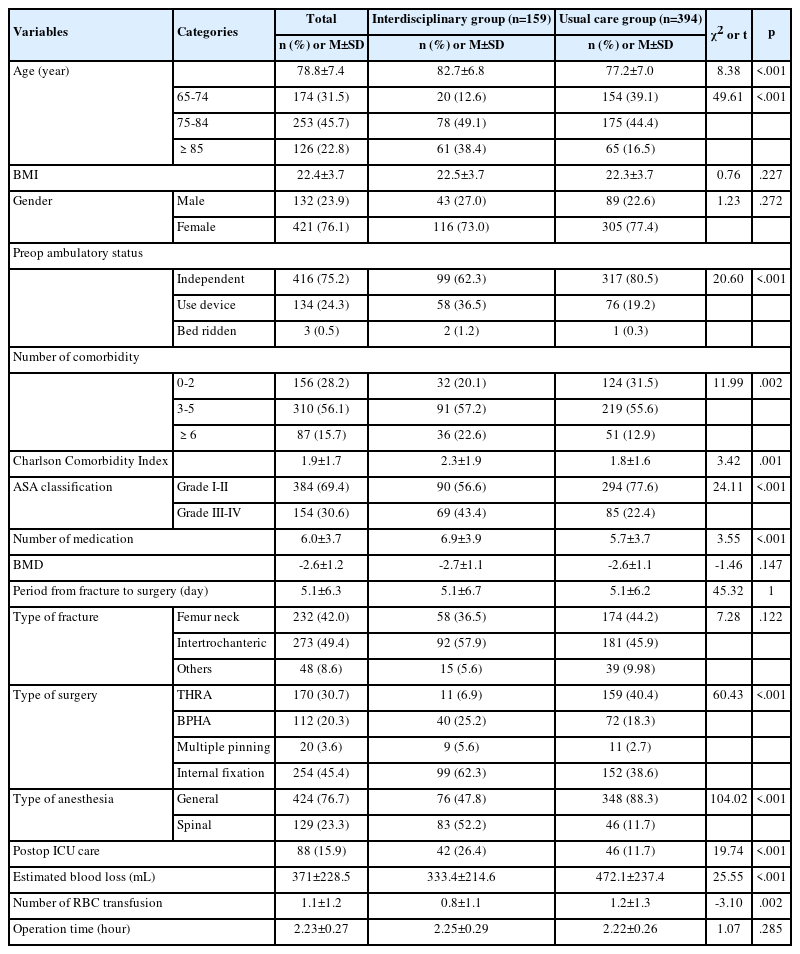
실험 첫째 날 측정한 실험 동물의 체중은 그룹 간에 차이 없이 동질한 것으로 확인되었다(F=.25, p=.860). 실험 마지막 날에는 구속 스트레스를 적용했던 스트레스군(p=.021), 사카린 음료군(p=.040) 그리고 자당 음료군(p=.030) 모두 대조군보다 체중이 적게 측정되었다(F=4.76, p=.010). 실험 마지막 날의 스트레스군 체중과 사카린 음료군(p=.999)과 자당 음료군(p=.947)의 체중은 모두 유의한 차이가 없었다. 7일의 중재 기간 동안 일 평균 사료 섭취량은 그룹 간의 차이가 없는 것으로 나타났다(F=1.38, p=.268). 일 평균 음수량은 대조군과 스트레스군(p=.588)의 섭취량은 통계적 차이가 없었으며, 스트레스군에 비해 사카린 음료군(p<.001)과 자당 음료군(p=.032)의 음수량은 모두 유의하게 증가된 것으로 나타났다(F=43.43, p<.001)(Table 1).
2. 그룹별 혈중 코르티코스테론 농도 비교
실험 종결 시점에서 측정된 혈중 코르티코스테론 농도는 그룹에 따라 다른 결과를 나타냈다(F=8.07, p=.002)(Table 1). 스트레스군과 대조군의 혈중 코르티스테론 농도는 각각 213.00±35.70 ng/mL와 78.64±7.01 ng/mL로 그 차이가 2배 이상 나타났다(p=.001). 한편, 사카린 음료군(p=.251)과 자당 음료군(p=.206)은 스트레스군 보다 낮은 수치를 나타냈으나 통계적으로 유의한 차이를 나타내지 않았다.
3. 개방장소 탐색활동도 검사(Open field test)를 통한 불안 정도 비교
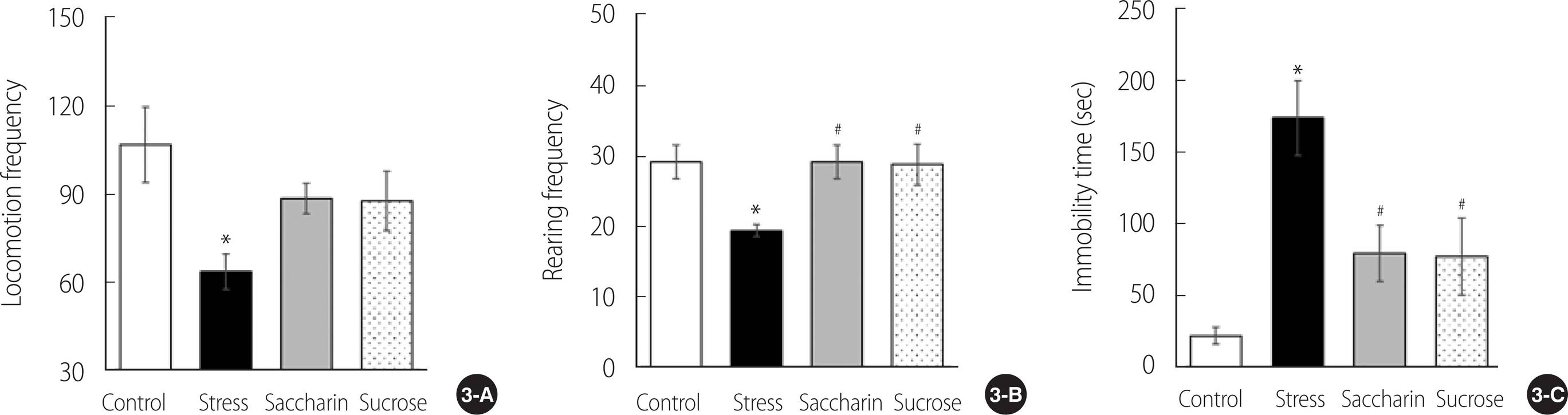
보행활동도는 대조군에서 가장 많은 빈도로 관찰되었고, 스트레스군(p=.019)은 이에 비해 더 낮은 움직임의 빈도가 관찰되었다. 그러나 사카린 음료군(p=.250)과 자당 음료군(p=.275)의 보행활동도는 스트레스군과 비교하여 차이가 없는 것으로 나타났다(F=3.79, p=.031)(Figure 3A). 일어서기는 스트레스군(p=.036)에서 가장 낮은 빈도로 기록되었으며, 사카린 음료군(p=.036)과 자당 음료군(p=.046)은 스트레스군 보다 높은 빈도로 측정되었다(F=4.48, p=.018)(Figure 3B).
4. 강제 수영 검사(Forced swim test)를 통한 우울 정도 비교
강제 수영 검사에서 측정된 부동 시간은 스트레스군에서 가장 길게 측정되며 그룹 간의 차이를 나타냈다(F=10.10, p<.001). 스트레스군의 부동시간은 173.80±25.95초로 대조군의 부동시간인 22.10±5.70 초보다 7배가량 길게 나타났다(p<.001). 사카린 음료군(p=.019)과 자당 음료군(p=.016)의 부동시간은 스트레스군의 부동시간에 비해 유의하게 감소된 것으로 확인되었다(Figure 3C).
5. 그룹별 전두엽 피질과 편도체의 가바성 신경세포(GABAergic neuron) 표지자의 발현량 비교
전두엽 피질에서 그룹별 차이를 보인 가바성 신경세포 표지자는 GAD67 (F=10.44, p<.001)과 Calbindin (F=10.00, p<.001)이다. GAD67은 스트레스군(p=.002)이 대조군에 비해 유의하게 감소되었으며, 자당 음료군(p<.001)과 사카린 음료군(p<.001)은 모두 스트레스군에 비해 유의하게 증가된 것으로 나타났다. Calbindin도 GAD67과 동일한 양상으로 나타나 대조군에 비해 스트레스군(p<.001)에서 감소하고, 스트레스군에 비해 자당 음료군(p=.013)과 사카린 음료군(p=.010)에서 유의하게 증가한 것으로 나타났다. 전두엽 피질의 parvalbumin 발현량은 그룹 간 차이가 없는 것으로 확 인되었다(F=.369, p=.776)(Figure 4A).

Western blot results of GABAergic neuronal markers in the frontal cortex (4-A) and the amygdala (4-B). Data are normalized to β-actin and expressed as mean±S.E., *p<.05 compare to Control group, #p<.05 compare to Stress group, S.E.=standard error; GABA=gamma-aminobutyric acid; GAD67=glutamate decarboxylase-67.
편도체에서 그룹별 가바성 신경세포 표지자 발현량의 차이는 전두엽 피질과 유사한 양상으로 나타났다. GAD67은 스트레스군(p=.021)에서 대조군에 비해 감소하고, 자당 음료군(p=.007)과 사카린 음료군(p=.003)은 스트레스군에 비해서 모두 유의한 증가 양상이 관찰되었다(F=7.06, p=.003). 편도체의 Calbindin 발현량도 마찬가지로 스트레스군(p<.001)에서 대조군보다 감소되었으나 자당 음료군(p=.001)과 사카린 음료군(p<.001)에서는 스트레스군 보다 증가된 발현량을 나타내었다 (F=16.68, p<.001). 편도체의 Parvalbumin은 그룹 간 차이가 없는 것으로 나타났다(F=.135, p=.938)(Figure 4B).
논 의
본 연구는 청소년기의 쥐에게 사카린 음료와 자당 음료를 자유롭게 섭취하도록 하였을 때 구속 스트레스로 인한 GABA성 신경세포 지표의 감소를 억제하고, 불안 및 우울 행동을 완화시키는 결과를 확인하였다. 사카린 음료나 자당 음료는 스트레스로 인한 불안과 우울 행동 완화에 모두 유사한 효과를 나타냈고, 이때 GABA성 신경세포의 지표 중 GAD67과 calbindin의 감소를 억제하여 억제성 신경의 활성을 유지시키는 것으로 확인되었다.
일반적으로 실험 쥐는 스트레스 반응에 대해 혈중 코르티코스테론의 급격한 증가를 보이며, 불안 행동과 우울 행동이 증가한다[22]. 스트레스로 인한 코르티코스테론의 증가를 억제하는 효과는 고농도의 자당 음료, 사카린 음료, 고지방 식이를 제공받은 쥐에서도 관찰된 바 있다[22,30]. 본 연구에서는 스트레스군의 혈중 코르티코스테론이 유의하게 증가하였고, 사카린 음료군과 자당음료군에서 감소하는 결과를 보였으나, 통계적으로 유의미하지 않았다. 스트레스로 인한 혈중 코르티코스테론의 농도는 스트레스 직후 가장 높게 기록되며 시간이 경과할수록 낮아진다[22,30]. 그러나 본 연구에서는 스트레스 직후 혈액 검사를 시행한 선행 연구[22,30]와 달리 연구 종료 시점에서 채취한 혈액을 이용하였기 때문에 이러한 결과의 차이가 발생했다고 볼 수 있다. 스트레스로 인한 반응을 확인하기 위한 방법으로서 혈중 코르티코스테론 수치를 활용하기 위해서는 시간 경과에 따른 경과 관찰이 필요할 것으로 보인다.
스트레스를 제공한 실험 쥐에 가당 음료를 제공했을 때의 음수량은 일반물의 음수량에 비해 증가하는 것으로 알려져 있다[25]. 본 연구에서는 사카린 음료군의 음수량이 특히 많은 것으로 나타났다. 사카린은 설탕의 단 맛에 비해 약 100-300배 이상의 단 맛을 내는데[21], 본 연구에서 사용된 두 음료의 농도 차이가 10배였다. 따라서 사카린 음료의 당도가 더 높았기 때문에 발생한 결과로 설명할 수 있다. 한편, 자당 음료군이 음료 속 백설탕을 섭취했음에도 선행 연구와 달리 체중이 증가하지 않았는데[25], 이는 본 연구의 자당 음 료가 선행 연구의 음료 농도 보다 30배 희석된 차이에서 비롯한 것으로 보인다. 그렇지만 본 연구에서는 상대적으로 적은 농도의 자당 음료로도 우울과 불안 행동을 완화를 확인하였다는 것은 의미 있는 결과이며, 추후에는 농도를 달리하여 최적의 농도를 탐색하는 연구가 필요할 것으로 보인다.
본 연구에서 사카린 음료군과 자당 음료군은 모두 스트레스군보다 불안과 우울 행동이 감소하였다. 이는 스트레스 중재 기간 동안 사카린 음료나 자당음료 또는 고지방 식이를 섭취한 실험 쥐의 행동 양상 변화와 일치한다[23,25,30]. 일반적으로 스트레스로 인한 실험 쥐의 불안과 우울 행동은 편도체에서 GABA의 억제성 신경 전달이 감소하고, 흥분성 신경전달이 강화된 결과에서 비롯된다고 알려져 있다[11-14,31]. 그리고 전두엽 피질과 편도체는 신경 회로로 연결되어 함께 기능한다고 보고된 바 있다[32,33]. 본 연구에서는 이러한 행동 양상의 차이를 감정 조절 중추인 전두엽 피질과 편도체의 GABA성 신경세포 관련 인자의 변화로도 확인하였다.
먼저 스트레스군에서 GABA의 합성 효소인 GAD67이 전두엽 피질과 편도체에서 감소된 것은 선행 연구와 일치하는 결과이다[11,16]. GAD67의 감소는 GABA성 신경 신호 감소에 영향을 미치므로 흥분성 신경 신호의 상대적 강화를 초래하였을 것으로 유추할 수 있다[34,35]. 반면에 사카린 음료군과 자당 음료군에서 GAD67이 대조군 수준으로 증가되었다. 본 연구에서는 직접적인 신경 세포의 활성에 관련된 지표를 확인하지는 못하였으나 사카린 음료군과 자당 음료군의 GAD67 변화는 GABA성 신경 신호를 유지하여 스트레스로 흥분성 신경의 강화를 완화하였을 것을 사료된다.
GABA성 신경신경세포 분포를 확인하기 위하여 분석한 calbindin과 parvalbumin은 전두엽 피질과 편도체에 분포한 GABA성 신경세포에서 많이 발견된다[17,36,37]. 본 연구에서 사카린 음료군과 자당 음료군은 calbindin이 전두엽 피질과 편도체에서 스트레스군보다 증가하였다. Calbindin을 가진 세포는 편도체 외부에서 전달된 흥분성 신호를 받아 억제성 신호를 전달하는 역할을 한다[37]. 따라서 두 음료의 섭취는 calbindin을 정상 수준으로 유지함으로써 스트레스 반응에도 정상적인 억제성 신호를 전달하는 기능을 유지할 수 있었을 것으로 사료된다. 한편, 본 연구에서는 parvalbumin에 네 군 간의 차이가 없었는데, 5주 이상의 만성적 스트레스 중재 연구에서 calbindin의 차이 없이 parvalbumin이 감소된 것과는 대조되는 결과이다[16]. 이는 1주일의 단기간의 스트레스 중재로 parvalbumin에 비해 구성 비율이 낮은 calbindin의 변화가 초래되어 장기적인 스트레스 중재 효과와 차이를 나타내는 것으로 보인다[17]. 따라서 추후 사카린 음료와 자당 음료의 GABA성 신경세포에 대한 장기적인 효과를 확인하기 위해서는 스트레스 중재 기간에 따른 변화를 검증하는 연구가 필요하다.
시중에 판매되는 탄산음료를 비롯한 다양한 가당 음료의 당류 농도는 약 10%로 알려져 있다. 이와 같은 가당 음료를 자주 섭취하는 청소년은 과체중이나 비만의 될 위험이 증가할 뿐만 아니라 대사증후군이나 심혈관 질환의 위험 요인에 노출될 가능성도 증가한다[38-40]. 스트레스는 청소년의 가당 음료나 고지방, 고탄수화물 음식에 대한 탐식 행위를 높이고, 그들의 건강 위협을 높이는 요인이다[41]. 본 연구에서는 청소년기 실험쥐에서 스트레스로 인해 사카린 음료와 자당 음료에 대한 자발적인 섭취량이 증가하는 것을 확인하였고, 특히 단 맛을 내면서도 열량이 없는 사카린 음료와 저농도의 자당 음료를 사용하여 체중 증가의 부작용 없이도 스트레스 완화 효과를 확인하였다는 데에 의의가 있다. 또한 단맛의 스트레스 완화기전이 전두엽 피질과 편도체에서 억제성 신경전달 회로의 변화를 통해 이루어졌음을 확인하였다.
본 연구는 실험 동물이 스트레스 자극에 대해 자발적으로 특정 음료를 섭취할 수 있도록 하여 보상 행위로서 가당 음료를 선택하는 실제 현상과 더 근접한 상황을 구성한 것에 의의가 있다. 또한 스트레스로 초래되는 코르티코스테론의 증가와 GABA성 신경세포 표지자의 감소 현상이 자당 음료와 사카린 음료 섭취시 모두 반전되는 것을 확인하였다. 하지만 자당 음료와 사카린 음료 각각이 어떠한 기전을 거쳤는가에 대해서는 확인하지 못하였다. 두 물질의 공통된 특성인 단 맛이 이러한 영향을 미쳤을 것으로 사료된다. 동시에 최근 설탕과 인공감미료가 인체 대사에 다르게 영향을 미친다는 보고가 있으므로[8], 추후 연구에서는 두 물질의 작용 기전의 차이를 밝히는 연구도 필요할 것으로 보인다. 그리고 비교적 단기간의 관찰기간의 효과만을 확인하여 장기적인 영향에 대해서는 해석이 불가하는 제한점이 있다. 따라서 추후 연구에서는 중, 장기적인 효과에 대해서도 탐색하는 방안을 제안한다. 그리고 성호르몬 변화에 대한 영향을 최소화하고자 수컷 쥐만 이용하여 결과를 도출하였는데, 추후 연구에서는 결과의 일반화를 위하여 암컷 쥐에서 동일한 효과를 나타내는지에 대한 검정이 필요할 것이다.
결 론
본 연구는 청소년기 쥐에게 1주간 구속스트레스를 가하며 사카린 음료나 자당 음료를 제공하였을 때 편도체와 전두엽 피질에서의 GABA성 신경세포의 기능을 유지시키고, 불안과 우울 행동을 완화시키는 효과가 있는 것을 확인하였다. 이것은 곧 스트레스로 인해 나타나는 식행위의 변화가 일정 부분 스트레스로 인한 반응을 완화하는 데에 기여할 수 있음을 의미한다. 따라서 향후 연구자들은 청소년기 스트레스 관리에 대한 연구 및 중재를 시도할 때 본 연구의 결과를 바탕으로 신경생리학적 현상을 반영하여 수행할 필요가 있다. 추후 연구에서는 인간을 대상으로 적정한 단 음료의 농도와 이에 따른 스트레스 완화 효과를 검증할 수 있는 연구를 진행할 것을 제언한다.
CONFLICT OF INTEREST
The authors declared no conflict of interest.
AUTHORSHIP
KYJ and KYJ contributed to the conception and design of this study; KYJ and SMK conducted the all of experiment; PJM performed the statistical analysis and interpretation; KYJ drafted the manuscript; KYJ critically revised the manu manuscript, and supervised the whole study process. All authors read and approved the final manuscript.