성인 중환자실에서 인공기도를 가진 환자의 의료기기 관련 구강점막욕창 발생의 위험요인
Risk Factors for Medical Device-related Oral Mucosa Pressure Ulcer Development of Intubated Patients in Adult Intensive Care Unit
Article information
Abstract
Purpose: This study was performed to identify the risk factors for oral mucosa pressure ulcer development in intubated patients in adult intensive care unit. Methods: Comparative descriptive study design using prospective observational design and medical record review was used. The inclusion criteria of case was that a) patients of 18 years in their age, b) patients with endotracheal tube. Data of 34 patients were analysed. Descriptive statistics, chi-square test, Fisher’s exact test, Mann-whitney test, Spearman’s rho correlation coefficients, and multiple logistic regression analysis were used. Resampling methods such as bootstrap was used in this study because of small number of patients. Results: Oral mucosa pressure ulcer developed in 44.1% of the intubated patients. The risk factors of oral mucosa pressure ulcer were steroid use, biteblock use and serum albumin level. Compared to the non-user of steroid, user of steroid had 32.59 times (95% CI: 1.47-722.44) higher risk of developing oral mucosa pressure ulcer. The user of biteblock had 18.78 times (95% CI: 1.00-354.40) and albumin level had 0.03 times (95% CI: 0.00-0.80) higher risk of oral mucosa pressure ulcer incidence. Conclusion: Based on the results of this study, tailored pressure relief strategies considering sex and therapeutic condition should be provided to decrease oral mucosa pressure ulcer.
서 론
1. 연구의 필요성
의료기기 관련 욕창(Medical device-related pressure ulcer)은 욕창의 유형 중 하나로, 진단이나 치료 목적으로 환자에게 사용되는 의료기기에 의해 피부나 점막조직에 지속적인 압력이 가해져 발생되며[1], 의료기기와 맞닿는 부위에 그 압력이 가해져 기구의 모양에 따라 피부와 점막 등에 발생하는 것이 특징이다[2]. 의료기기 관련 욕창은 중환자실 뿐 만 아니라 산부인과, 소아과, 외상센터, 재활병동 등에서 주로 발생하며[3] 국제적으로 중요하게 평가하고 있는 간호성과의 지표이고 국내에서도 의료기관인증평가 기준에 포함되는 등 간호 질관리 지표 중 하나로 중요성이 점차 커지고 있다. 체계 적 문헌고찰에 따르면 의료기기 관련 욕창의 발생률은 0.4%에서 41.2%까지 다양하게 보고되고 있으며[4] 이는 일반 피부욕창의 누적 발생률의 범위가 10-25.9%에 해당한다는 연구[5]에 비해 발생률의 범위가 넓어 예방의 중요성을 보여주고 있다. 특히 의료기기 관련 구강점막욕창의 발생률에 대해서 연구가 많이 이루어져 온 것은 아니어서 일반화하기는 어려우나 일 연구에서 중환자실에서 보고된 욕창의 6.6%에서 9.2%가 구강이나 입술에 발생한 욕창이라고 보고하였다[6].
일반적으로 의료기기 관련 욕창의 위험요인에 관해서는 현재까지 많은 연구가 이루어지고 있으나 구강점막욕창에 대해서는 그 위험요인이 다양하게 밝혀져 있지 않다. 먼저 조직의 여러가지 측면은 의료기기관련 욕창의 발생에 영향을 줄 수 있겠으나 그 중 하나로 병원 유형을 들 수 있다. 의료기기 관련 욕창발생에 대한 연구에서 기관 내관에 의한 구강욕창의 발생은 높은 빈도를 보이지만[7], 구강점막욕창의 경우 아직 간호사들은 임상적 구별을 어려워하고, 구강사정 시 바이트브럭등의 위치가 변경되어 빠질 수 있는 위험 때문에[8] 간호에 있어 소극적인 태도를 유발할 수 있다. 이에 기관 내 삽관 중인 환자를 자주 돌보는 의료기관의 경우 욕창예방태도나 간호수행정도가 다를 수 있다. 또, 환자 대 간호사의 비율은[9] 피부욕창의 발생률에 영향을 미치는 요인인 것으로 알려져 온 만큼 의료기기 관련 구강점막욕창 발생과의 관련성 또한 규명해볼 필요가 있겠다.
환자의 치료관련 요인으로는 입원기간이나 환자에게 적용되는 기구나 약물등을 들 수 있다. 의료기기 관련 피부욕창의 경우, 인공호흡기 사용으로 움직임이 제한받는 기간이 늘어날수록 발생률이 증가하고[10] 억제대를 적용하는 환자는 움직임의 제한으로 인해 욕창 발생이 증가하였다[11,12]. 이와 유사하게 기관 내관을 유지하는 동안 입 주변 움직임이 제한되고 기관 내관 고정장치가 입술과 점막에 억제대와 같이 물리적인 압박을 주게 되므로 욕창발생 위험이 높아질 것으로 유추된다. 환자들이 사용하는 약물 중 승압제의 사용은 혈관수축을 유발하여 평균 동맥압을 높이고 그에 따른 결과로 조직의 관류가 줄어들 수 있으므로 욕창의 위험을 높일 수 있다[13]. 또한, 진정제를 사용하지 않는 경우 의식이 깨어있어 불편감을 호소할 수 있고, 자발적인 움직임이 가능하여 스스로 의료기기의 위치변경이 가능하기 때문에 욕창발생의 위험이 줄어든다[14]. 따라서 진정제를 사용하는 경우 이와 반대로 움직임이 불가능하므로 구강점막욕창에 위험요인이 될 것으로 여겨졌다. 스테로이드를 사용하는 경우 욕창의 발생을 증가시키는 요인으로 작용한다는 연구결과가 있으며[15,16], 진통제를 비롯한 다양한 약물의 사용은 욕창 발생을 증가시키는 것으로 나타났다[10,17]. 이와 같은 특성들은 의료기기 관련 욕창에서 위험요인인 것으로 알려져 왔으므로 의료기기 관련 구강점막욕창에도 적용이 되는지 확인해볼 필요가 있다.
마지막으로 욕창 발생에 영향을 주는 생리지표 요인들도 영향을 미칠 수 있다. 영양상태를 나타내는 생리지표인 헤모글로빈, 헤마토크릿, 알부민은 욕창의 발생과 관련이 있으며 이러한 수치가 불량할수록 욕창 발생률은 증가한다는 연구결과가 있다[7]. 그 이유는 이 생리지표들은 상처입은 조직에 영양을 공급하는 역할을 할 뿐만 아니라 알부민의 경우 실제 신체를 구성하는 단백질의 구성요소이기 때문에 욕창의 발생과 민감한 관련성이 있는 것으로 보고된다[18]. 또한 높은 혈중요소질소(BUN)로 대표되는 신기능 부전은 욕창의 발생과 상관성이 있는 것으로 보고되므로[19] 위험요인을 고려해서 규명할 필요가 있다.
이상 살펴본 국내외의 연구결과는 주로 일반적인 욕창에 관하여 분석한 연구가 대부분이었고, 의료기기와 관련되었다 하더라도 피부욕창에 대한 위험요인이 대부분이었으므로 구강점막욕창에 적용하기 어렵다. 구강점막조직은 피부조직과 해부학적인 특성의 차이로 욕창을 구분하는데 있어서도 단계의 구분이 없이 욕창의 유무로만 측정하도록 권고되고 있고[1] 예방과 치료에 있어서도 규명된 바가 부족하여 실제 임상에 근무하는 의료진에게 생소하게 받아들여지고 있는 실정이다. 또한 2-3일 내에 급속히 발생하여 호전과 재발이 빈번하므로[20] 환자에게 불편감을 초래함은 물론 구강 내 감염의 통로를 가지고 있는 상황에서의 상처는 전신감염의 가능성 증가시켜[21] 환자의 삶의 질에 부정적인 영향을 줄 수 있다. 이에 본 연구에서는 의료기기 관련 구강점막욕창에 영향을 미치는 위험요인을 규명하여 궁극적으로 구강점막욕창의 발생률을 낮추는데 기여하기 위해 본 연구를 수행하였다.
2. 연구의 목적
본 연구는 기관 내 삽관 중인 중환자실 환자의 구강점막욕창 발생실태를 파악하고 구강점막욕창발생에 영향을 미치는 위험요인을 규명하기 위함이며 구체적인 목적은 다음과 같다.
첫째, 구강점막욕창의 발생 실태를 파악하고, 구강점막욕창 발생과 비발생군 간의 특성의 차이를 비교한다.
둘째, 구강점막욕창 발생에 영향을 미치는 위험요인을 파악한다.
연구 방법
1. 연구설계
본 연구는 성인 중환자실에 입실하여 기관내관을 적용중인 환자 의 의료기기 관련 구강점막욕창에 영향을 주는 위험요인을 파악하기 위한 비교서술설계(comparative descriptive design) 연구이다.
2. 연구대상
본 연구의 대상자는 B시에 위치한 상급종합병원과 종합병원에 입원하여 기관 내 삽관 중인 환자이다. 구체적인 선정기준은 a) 18세 이상이며, b) 성인 중환자실에 입원한 환자, c) 접착 테이프, 거즈 및 상업용 고정장치를 포함한 고정 방법과 함께 기관 내 삽관 중인 환자, 그리고 d) 본인이나 법정대리인이 연구참여에 동의한 환자이다. 일개 상급종합병원의 8개 중환자실 중 3개의 중환자실에서 관찰을 하도록 병원과 간호부로 부터 허가를 받았으며 감염 등을 이유로 1명의 관찰인원과 한 달 이내의 기간 이내로 제한을 받았다. 이에 분석에 적합한 수를 추가로 모집하기 위해 일개 종합병원에서의 관찰 가능성을 타진하였고 1개 중환자실에서 3개월간 관찰에 대한 허가를 받아 관찰하였으므로 이 두 개의 기관에서 수집한 대상자는 34명이었다.
3. 연구도구
1) 일반적 특성 및 조직관련 변수
대상자의 일반적 특성은 성별, 연령, 병원 유형의 3가지를 측정하였고, 병원 유형은 상급종합병원과 종합병원으로 구분하였다.
2) 치료관련변수
대상자의 치료관련 변수는 바이트블럭(물림보호대), 승압제, 스테로이드, 진정제의 사용여부와 인공호흡기의 사용기간까지 총 5가지 항목에 대해 확인하였다. 이에 대해 사용하면 1로, 사용하지 않으면 0으로 입력하여 분석에 활용하였고, 인공호흡기 사용기간은 사용일 수를 그대로 분석에 투입하였다.
3) 생리지표변수
대상자의 생리지표로는 흡입산소농도(%), 백혈구(103/mm3), 헤모글로빈(mg/dL), 헤마토크릿(%), 알부민(g/dL), 혈중요소질소(mg/dL), 크레아티닌(mg/dL)의 7가지 항목을 매일 오전에 측정한 수치를 활용하였다.
4) 구강점막욕창 사정
구강점막욕창의 유무를 판별하기 위하여 Reaper Oral Mucosa Pressure Injury Scale (ROMPIS)[21]를 사용하였는데, 이 도구는 단일문항으로 0에서 3단계로 평가하도록 이루어져 있다. 0단계는 ‘정상’, 1단계는 ‘입술과 점막이 붉음, 다른 조직과 구분됨, 피부의 벗겨짐이나 궤양 물집없음, 지속적인 발적’, 2단계는 ‘점막의 벗겨짐, 붉은 혈액응고 흔적이 보임, 구강 주변조직의 얕은 벗겨짐’, 3단계는 ‘근막의 노출, 입술이나 구강주변조직의 근육 노출’을 각각 나타낸다. 구강점막 욕창의 사정을 위해서 환자의 담당의료진 입회하에 환자에게 적용된 기관내관은 분리하지 않은 상태에서 입술과 구강점막부위가 완전히 관찰 가능하도록 하여 사정을 시행하였다. 예비 환자 평가를 수행한 후 두 관찰자 사이의 평가자 간 신뢰도를 확인하였을 때, 0.573의 일치도를 보여 Landis와 Koch의 기준에 따라 ‘적당히 일치하는 수준’으로 나타났다. 이는 ROMPIS를 바탕으로 19장의 사진자료를 평가하게 하였을 때 평가자 간 신뢰도가 0.463로 나타난 결과[21]보다는 높았다. 본 연구에서는 구강점막의 상태를 관찰한 후에 0에서 3까지의 단계를 표시하여 실제 발생단계를 함께 파악하였고, 발생률과 발생에 영향을 미치는 위험요인을 분석하기 위해서는 정상상태 (Stage 0)는 0으로 코딩하였고, 구강점막욕창의 발생 (Stage 1-3)은 1로 코딩을 변경하여 분석하였다.
4. 자료수집방법
자료수집은 두 번에 나누어 시행하였으며, 첫 번째는 2017년 9월 한달 동안, 두 번째는 2019년 3-5월로 총 4개월간이었다. 이와 같이 두 번의 자료수집 간의 간격이 길어진 이유는 두 번째 관찰기관인 종합병원에서 허락을 받는 과정과 관찰기관이 달라진 이유로 윤리위원회의 연구승인을 추가로 받는 기간이 소요되었기 때문이다. 하지만 이 기간 동안 종합병원에서의 의료기기 관련 구강점막욕창의 발생에 영향을 줄 수 있는 병원의 상황이 크게 바뀌지 않아 연구결과에는 영향을 미치지 않을 것으로 판단하여 자료수집을 진행하였다. 이에 구강점막욕창 환자의 관찰은 훈련된 연구 조교 1인과 구강점막욕창을 연구해 온 간호학 교수 1인이 매일 같은 시간에 방문하여 해당 환자를 대상으로 구강점막욕창의 단계를 확인하였다. 측정자 간 일치도 평가를 위해 연구자가 준비한 17개의 구강점막욕창 사진을 활용하여 일치도를 확인한 후 유사한 시간에 환자를 방문하여 욕창발생을 관찰하였다. 의무기록 관찰은 훈련된 연구조교 2인이 대상자의 치료관련변수와 생리지표변수에 대하여 구조화된 기록지를 사용하여 수집하였다. 34명의 대상자들을 매일 관찰한 후 욕창이 발생한 경우 발생시점의 치료관련, 생리지표변수들을 의무기록으로부터 수집하였고, 욕창이 발생하지 않은 경우는 기관내관 대신 기관절개술을 적용하거나 인공호흡기를 제거하거나 퇴원하는 경우로 관찰 마지막 날의 자료를 발췌하여 분석에 적용하였다. 이는 다른 피부욕창의 경우 입원기간이 욕창발생에 유의미한 영향을 미치는 것으로 나타난 연구[7]를 기초로 하였다.
5. 윤리적 고려
연구는 B시 소재의 P대학교의 Institutional Review Board (IRB)의 연구승인(1041386-201707-HR-021-03)과 D 의료원의 연구승인(DAUHIRB-19-072)을 받은 후 시행되었다. 연구자가 직접 연구대상자나 법정대리인에게 연구의 목적과 의의, 자료의 익명성, 비밀보장, 참여 및 불참에 따른 이익과 불이익이 없음, 수집된 자료는 보안장치가 있는 곳에서 안전하게 보관 후 일정 기간 이후에 영구적으로 폐기됨 등에 관해 설명하고 서면동의서를 받았다.
6. 자료분석
수집된 자료는 SPSS WIN 25.0 program을 이용하여 분석하였으며 모든 통계적 검정은 양측검정으로 하여 유의수준 α=.05로 분석하였다. 대상자의 일반적 특성은 빈도와 백분율, 평균과 표준편차로 하였고, 일반적 특성에 따른 구강점막욕창의 발생은 Chi-square test, Fisher’s exact test, Mann-Whitney test로 분석하였다. 변수 간의 상관성은 다중공선성 등을 평가하기 위해 Spearman‘s rho correlation coefficients를 적용하였다. 구강점막욕창 발생의 예측 위험요인을 파악하기 위해서 다변량 로지스틱 회귀분석을 실시하였다. 본 연구에서는 연구대상 환자의 수가 34명으로 작을 뿐만 아니라 관련 변수들의 값이 정규분포를 이루지 않음에 따라 더 나은 예측모델을 구축하기 위해서 부트스트랩 분석방법(10,000 재표본방법)을 적용하여 교차비를 구하였다. 재표본 방법은 training set에서 표본을 뽑고 반복해서 모델을 적합시켜보는 것으로 training set을 한번만 쓰는 것보다 추가적인 정보를 줄 수 있어서 발생사례가 희귀한 임상정보의 분석에 주로 활용되고 있다[22]. 부트스트랩은 내적 검증으로 낙관주의(optimism)와 과적합(overfitting)을 해결하여 낮은 편향으로 강력한 추정치를 제공한다[23].
연구 결과
1. 대상자의 일반적 특성 및 구강점막욕창 발생군과 비발생군의 특성비교
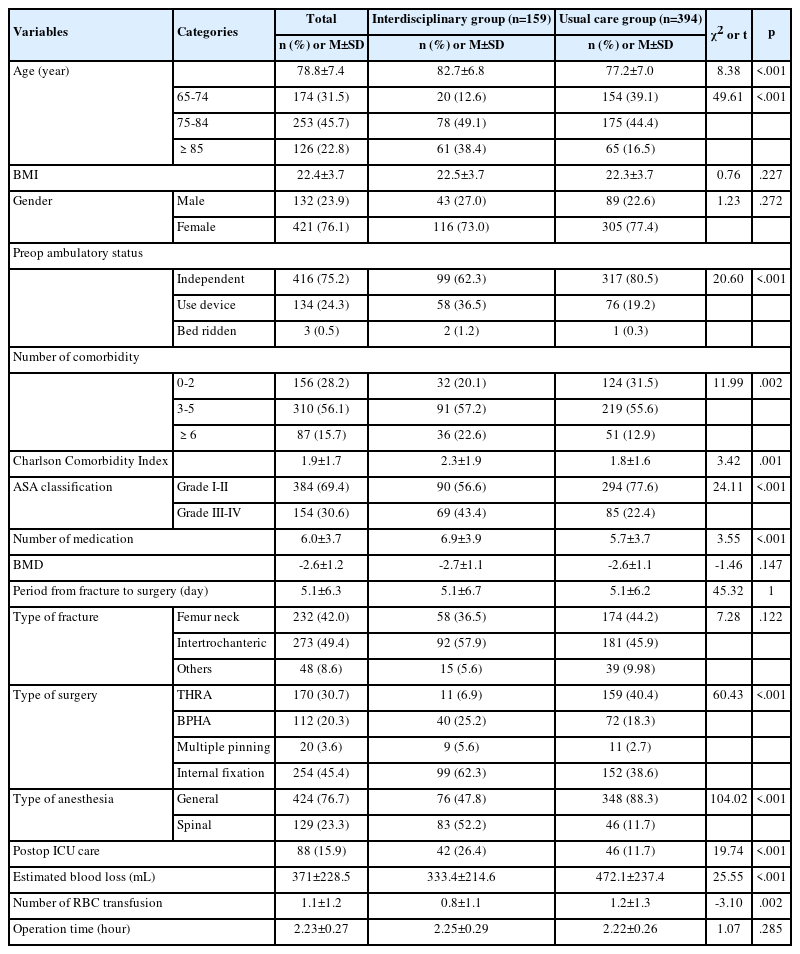
구강점막욕창은 44.1% (15명)의 환자에게서 나타났고, 욕창발생군의 일반적 특성을 살펴보면 남자가 56.5% (13명)를 차지하였고, 여성이 18.2% (2명)를 차지하였다. 발생군의 평균연령은 60.00±8.55세로 비발생군과 차이가 없었다. 바이트블럭을 사용하는 대상자 중 60% (12명)에서 욕창이 발생하였고, 사용하지 않는 경우에도 21.4% (3명) 발생하여 통계적으로 유의한 차이가 있었다(χ2=4.97, p=.026). 스테로이드를 사용하는 경우 77.8%에서 구강점막욕창이 발생하였고 사용하지 않는 경우 32%가 발생하였다(χ2=5.63, p=.025). 구강점막욕창 발생군의 알부민 수치 평균은 2.27±0.54로 비발생군의 평균 3.12±0.45보다 유의미하게 낮았다 (Z=2.34, p=.026)(Table 1).
2. 구강점막욕창 발생에 영향을 주는 위험요인
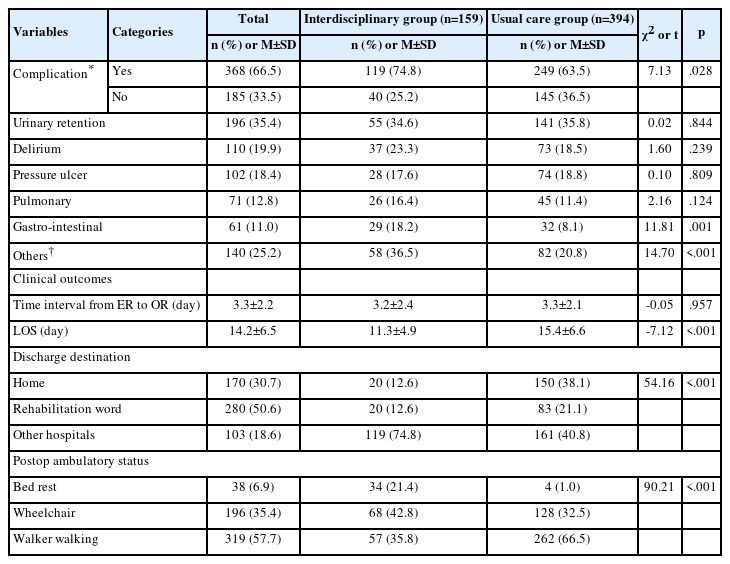
구강점막욕창 발생에 영향을 주는 변수를 규명하기 위해서 통계적으로 유의한 차이를 보였던 바이트블럭 사용여부, 스테로이드 사용여부, 알부민 수치를 독립변수로 투입하였다. Hosmer&Lemeshow 검정결과 χ2=7.29(p=.506)로 변인들에 의해 욕창 발생여부를 잘 예측할 수 있는 것으로 나타났다. 변인들에 의한 설명력은 Cox&Snell’s R2 값은 .498이었고, Nagelkerke’s R2은 .668이었다. 구강점막욕창 발생에 영향을 미치는 유의한 영향을 미치는 변수는 스테로이드 사용여부(B=3.48 p=.028), 바이트블럭 사용여부(B=2.93 p=.050), 알부민 수치(B=-3.62 p=.037)로 나타났다. 이 변수에 따른 의료기기 관련 구강점막욕창발생의 상대위험도를 살펴보면 스테로이드를 사용하는 경우는 그렇지 않은 경우에 비해 욕창발생군으로 분류될 가능성이 32.59배(95% CI: 1.47-722.44) 높았으며, 바이트블럭을 사용하는 경우에도 사용하지 않은 경우에 비해 욕창발생군으로 분류될 가능성이 18.78배(95% CI: 1.00-354.40) 높았다. 알부민은 수치가 높을수록 0.03배 (95% CI: 0.00-0.80) 높았다(Table 2).
논 의
본 연구는 중환자실에 입원한 기관 내 삽관 환자를 대상으로 의료기기 관련 구강점막욕창 발생을 관찰하고 발생에 영향을 미치는 위험요인을 규명하고자 수행한 연구이므로 이를 중심으로 논의하고자 한다. 우선, 대상자 중 44.1%에서 구강점막욕창이 발생하였는데 이는 최근의 연구에서 환자의 20.54%에게 피부 혹은 점막에 의료기기 관련 욕창이 발생하였다고 보고한 것에 비해서 높은 편이었다[24]. 구강점막욕창은 다른 의료기기 관련 욕창보다 발생률이 높고, 기록된 모든 의료기기 관련 욕창의 22.6%가 구강점막욕창임을 보고하였으나[25] 본 연구의 결과보다는 낮은 것을 볼 수 있었다. 본 연구에서는 다른 연구에 비해 구강점막욕창을 관찰하는 도구를 활용하여 면밀하게 관찰하였으므로 가시화되기 전인 비창백성 홍반을 포함한 구강점막욕창의 1단계를 다른 연구에서보다 더 많이 포함시켰기 때문으로 볼 수 있다. 체계적 문헌고찰에서도 의료기기 관련 욕창의 발생률은 이질성이 매우 높게 나타났는데 이는 임상적 환경, 환자의 특성, 기기의 종류, 욕창의 단계와 같은 요인들이 다르기 때문이라고 보았으므로[26] 다른 연구결과와 비교할 때 이 점들은 고려되어야 할 것이다. 특히, 의료기기 관련 욕창 중 호흡보조기기 관련 욕창의 발생률이 가장 높다는 연구[26,27]에 근거할 때, 기관 내관 뿐만 아니라 비강캐뉼라나 산소마스크 등의 사용에 특히 주의를 기울여야 할 것이다.
본 연구에서 구강점막욕창의 발생은 성별과 유의한 상관성이 없는 것으로 나타나 선행연구와[7] 차이를 보였다. 일반적으로 나이가 들면서 매년 1%의 콜라겐이 줄어들며, 남성에서보다 여성에서 피부 콜라겐의 양이 적은 것으로 알려져 있고[28], 테스토스테론의 감소에는 변화가 없었으나 에스트로겐이 감소한 그룹에서 성대 점막의 세포 외조직의 유전자 변화가 관찰되어 성호르몬의 영향을 받는 것으로 나타난 연구에 기초할 때, 성호르몬에 의해서 점막의 상태가 달라질 수 있다[29]. 본 연구에 포함된 환자들이 대부분이 고령이었고 대상자 수가 34명으로 적었기 때문에 유의한 요인이 아닌 것으로 나타났을 가능성이 있으므로 대상자 수를 늘려 반복연구하여 재검정해볼 필요가 있겠다.
구강점막욕창 발생의 위험요인으로는 스테로이드 사용, 바이트블럭 사용, 알부민 수치였다. 우선, 스테로이드(glucocorticoid)는 강력한 항염증 효과와 면역조절 효과를 가진 약제로 다양한 질환에서 사용되고 있고, 임상적으로는 염증부위로 백혈구가 이동하는 것을 막고 백혈구, 섬유모세포, 내피세포의 작용을 방해하며, 염증과정에 관여하는 체액인자의 생산과 작용을 억제하는 작용을 한다[30]. 본 연구에서는 스테로이드의 비사용자에 비해서 사용자가 32.59배 구강점막욕창의 발생위험이 높은 것으로 도출되었다. 스테로이드는 염증반응 시 혈관을 수축시켜 염증의 확산을 방지하기 위해 사용하며 대표적인 부작용으로 근육약화가 발생하므로 피부 욕창에 있어서 독립적인 위험인자로 보고되기도 하였다[15]. 이는 근육이 약화된 상태에서 기관 내관을 적용하게 됨으로써 입술 근육이 잘 받쳐주지 못해서[30] 점막욕창이 더 잘 발생한 것으로 유추된다. 뿐만 아니라 스테로이드의 사용은 피부과적으로도 피부의 위축, 상처치유의 지연, 입 주위 피부염 등으로 보고하므로[30] 스테로이드를 사용하는 기관 내 삽관환자는 보다 면밀한 관찰과 주의가 요구된다. 하지만, 질병에 의한 근육약화의 상황도 배제할 수 없으므로 해석에 주의를 요한다.
바이트블럭의 사용은 구강점막욕창 발생의 위험을 18.78배 높이는 요인으로, 위험요인들로 규명된 요인들 중 위험도를 가장 높이는 요인이었다. 바이트블럭이나 구강 인두관의 적용은 환자가 기관 내 관을 이로 물어 폐색되는 것을 막아주고 적절한 기도개방상태를 유지해주는 기능을 하지만, 중력에 의한 입의 다뭄현상 혹은 씹기 반응으로 인해서 바이트블럭이 입술조직에 압력을 가할 수 있다[31]. 특히 딱딱한 플라스틱으로 만들어져 있고, 기관 내관과의 고정을 위해 반창고나 거즈를 사용하여 고정하고 있다는 사실은 압력을 배가시킬 수 있고 양쪽 볼에도 영향을 줄 수 있으므로 주기적인 위치이동이 필요할 것으로 보인다. 따라서 2시간마다 바이트블럭 사용주위를 확인하고 4시간마다 위치를 변경해주는 예방적 간호행위가 필요하나[32] 아직 우리나라에서는 이런 지침이 마련되어 있지 않아서 장기적인 안목에서 지침의 마련이 필요하다고 여겨진다.
알부민 수치는 국내외 다수의 선행연구에서 욕창발생과 상관성이 있는 것으로 나타났으며, 혈청 알부민이 감소할수록 욕창 발생 위험비가 28.83배 높아진다는 연구[33] 와 욕창발생 뿐만 아니라 욕창의 중증도 역시 알부민 수치와 음의 상관관계가 있는 것으로 나타난 연구[34]를 볼 때 본 연구의 결과가 일치하였다. 알부민은 영양상태를 나타내는 지표로, 반감기가 20일 정도로 긴 특징으로 인하여 영양결핍 초기보다는 만성적인 영양 불균형 상태를 나타내는 지표로 적절하다. 일반적인 피부욕창에서도 알부민 수치에 따라서 욕창발생 위험률과 욕창중증도가 심화되므로 구강점막욕창을 관리하기 위해서 환자로 하여금 장기간에 걸쳐서 충분한 영양공급이 이루어지도록 주의해야 할 것이다.
이에 반해, 헤마토크릿과 인공호흡기 사용기간, 병원유형은 구강점막욕창 발생에 위험요인이 아니었다. 일반적으로 헤마토크릿은 욕창 발생과 유의한 음의 상관성을 보여서 영양부족의 지표인 헤마토크릿이 낮을수록 즉, 영양 상태가 좋지 않고 염증반응이 없는 경우 욕창의 발생률이 높아지는 것으로 나타났다[35]. 하지만 본 연구에서는 상관성이 없는 것으로 나타났는데 이는 반복연구를 통해 보다 면밀한 고찰이 이루어져야 하겠으나, 점막 상처의 특성 때문에 나타난 결과일 가능성이 있다. 구강점막은 얼마나 오랫동안 인공호흡기를 적용하였는가보다는 욕창이 발견되는 그 주변 어느 시점에 강한 압력을 받았는가가 더욱 중요하며, 빠른 발생과 치유의 주기, 반복적 발생 등을 특성으로 하므로[20] 인공호흡기 사용기간과 욕창발생 간에는 유의한 관련성이 나타나지 않은 것으로 보인다. 또, 일반적으로 환자 대 간호사 비율은 환자안전문제에 중요한 요인으로 이 비율이 한 단위 높아질 때 욕창발생 위험이 39% 낮아진다[36]. 특히 본 연구대상인 종합병원의 경우 상급종합병원에 비해서 간호사의 비율이 약간 낮았으므로 종합병원에서의 환자의 욕창발생률이 높을 것이라 예상하였으나 그렇지 않았다. 이는 크게 두가지로 설명이 가능한데 첫째, 앞서 언급한 여러 가지 위험요인들 중 구강점막욕창의 발생과 치유의 기간이 짧으며 반복된다는 특성 때문에 간호사들의 비율에 따른 간호에 큰 영향을 받는 피부욕창과 차이가 있었던 것으로 볼 수 있다[20]. 둘째, 그동안 간호사들이 기관 내관에 의한 구강점막의 욕창에 대한 관심이 낮았기 때문에 두 기관의 간호사들 대부분이 기관내관 사용과 관련한 욕창예방활동을 거의 하지 않았기 때문일 수도 있다[37]. 하지만, 이에 대해서는 구체적인 연구가 이루어지지 않은 만큼 반복연구를 수행해서 이들 간의 관련성을 재검정해 볼 필요가 있다.
이 결과를 바탕으로 할 때 구강점막욕창을 예방하기 위한 프로토콜의 목적은 크게 두 가지, 압력완화와 통합성 유지 증진으로 구성될 수 있다. 일반적으로 욕창발생의 강력한 원인은 마찰과 전단력이므로 예방을 위해서는 압력의 분산과 압력완화를 위한 드레싱 등이 권장되어 오고 있다[38]. 특히 바이트블럭의 눌림에 의해서 아랫입술에 발생하는 욕창의 경우에는 압력 완화가 매우 중요하며, 이를 위해서는 젤리 형태의 폼 드레싱이나 폴리우레탄 폼 드레싱제품[39]을 바이트블럭과 입술 사이에 끼워 압력을 완화하는 것이 중요할 것으로 보인다. 뿐만 아니라 초기 욕창에 대해서는 리놀렌산을 함유한 hyper-oxygenated fatty acids (HOFA) 용액은 점막의 통합성 유지를 돕고 점막의 욕창형성의 진행을 더디게 해주는 것으로 알려져 왔으므로[40] 이를 적용하는 것도 필요할 것으로 보인다. 뿐만 아니라 상처의 통합성 증진을 위한 내적인 요소인 알부민 수치를 일정수준 이상으로 유지하려는 노력이 추가된다면 구강점막욕창의 발생을 예방할 수 있을 것으로 보인다.
본 연구는 구강점막욕창에 대해 발생률을 파악하고 위험요인을 규명하여 이에 대한 관심을 유도하였다는데 의의가 있다. 하지만, 일 지역에 소재하는 병원을 대상으로 편의추출한 연구라는 측면에서 연구결과를 확대 해석하는 데는 주의가 따른다. 뿐만 아니라, 기저질환이나 더 많은 치료적 변수를 고려하지 못하였고, 통계적 기법을 활용하여 적은 환자 수를 활용한 분석을 보완하고자 하였으나 과잉적합이 나타났을 가능성이 존재하였다. 따라서 이를 보완하여 반복 연구할 것을 제언한다.
결 론
본 연구를 통해 구강점막욕창은 환자의 44.1%에서 나타났고, 발생에 미치는 위험요인은 스테로이드의 사용, 바이트블럭의 사용, 알부민 수치이었다. 이 연구에서의 욕창발생률은 높은 편에 해당하였고 피부욕창에서의 위험요인과 비교를 통해 그 중요성을 살펴보았으며, 일치하지 않는 부분도 많았던 것으로 확인되었다. 따라서 반복적인 연구를 통해 위험요인을 보다 정련화 할 필요가 있겠다. 또한, 의료기기 관련 욕창 중 구강점막욕창의 발생이 낮은 편이 아니 라는 연구들에 근거할 때, 이의 예방을 위한 프로토콜의 개발이 필요하며 향후 이를 접목하여 중재를 제공하여 그 효과를 검증해볼 필요가 있을 것으로 보인다.
CONFLICT OF INTEREST
The authors declared no conflict of interest.
AUTHORSHIP
KMK and KMS contributed to the conception and design of this study; KMS collected data; KMK and KMS performed the statistical analysis and interpretation; KMS drafted the manuscript; KMK and KMS critically revised the manuscript; KMS supervised the whole study process. All authors read and approved the final manuscript.